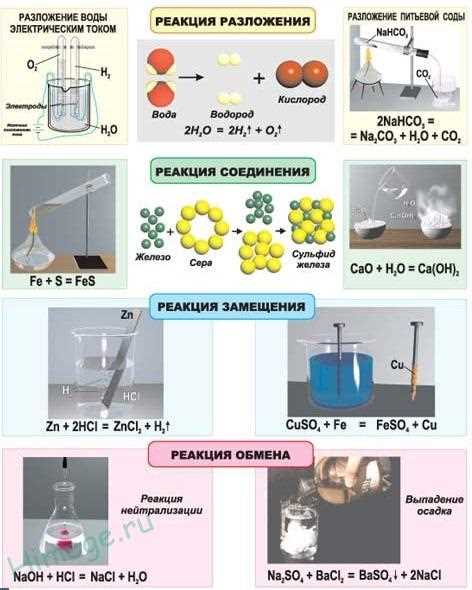
Биохимическая реакция — это процесс, который происходит в организме и обеспечивает его жизнедеятельность. Скорость биохимической реакции имеет огромное значение для живых организмов, поскольку она влияет на скорость метаболических процессов, которые управляют энергией и химическими реакциями в клетках. Понимание факторов, влияющих на скорость биохимической реакции и ее регуляцию, является ключевым для понимания многих биологических процессов.
Одним из основных факторов, влияющих на скорость биохимической реакции, является температура. При повышении температур реакция протекает быстрее, поскольку увеличивается средняя кинетическая энергия молекул, и они сталкиваются чаще. Это принцип, который обычно описывается законом Аррениуса. Однако при очень высоких температурах ферменты могут разрушаться, что может снизить скорость реакции.
Кроме температуры, концентрация вещества, насыщенного биохимической реакцией, также влияет на скорость реакции. Чем выше концентрация реагентов, тем больше шансов у них совершить эффективное взаимодействие. Кинетика реакции, которая зависит от концентрации реагентов, называется кинетикой порядка.
Более сложные факторы, такие как взаимодействие с ингибиторами или регуляторами, также могут влиять на скорость биохимической реакции. Ингибиторы могут замедлить реакцию, а регуляторы могут ее активировать или подавить.
Для измерения скорости реакции существует множество методов, одним из которых является спектрофотометрия. Этот метод основан на измерении изменения поглощения света раствора при прохождении через него.
Введение в основы скоростной кинетики биохимических реакций и их регуляции имеет большое значение, как для фундаментальных исследований в области биоинформатики и биологической диагностики, так и для промышленности и фармакокинетики. Понимание свойств биохимической реакции и ее механизмов будут полезными для разработки новых лекарственных препаратов, диагностических тестов и многих других областей биологии и химии.
Влияние концентрации реагентов на скорость реакции
Основой для объяснения этого явления служит теория активационной энергии, которая утверждает, что для того чтобы реакция происходила, необходимо преодолеть энергетический барьер, или активационный барьер. Более конкретно, активационная энергия — это минимальная энергия, которая требуется для того, чтобы начать процесс разложения реагентов и образования продуктов.
По принципу Михаэлиса-Ментен, кинетика ферментативных реакций имеет порядок второго, где скорость реакции равна кинетическим параметрам — константе скорости и концентрации субстрата. Поэтому увеличение концентрации субстрата увеличивает скорость реакции.
Моделирование и физико-химические принципы позволяют оценить влияние концентрации вещества на скорость реакции. Другое важное практическое применение кинетических параметров — это разработка катализаторов и ингибиторов для промышленных процессов. Катализ является одним из основных способов активации реакции снижением активационной энергии.
Для некоторых реакций, например, в газовых растворах или при повышенном давлении, скорость реакции может зависеть от концентрации газов. Также масса и разложение слабых кислот и оснований сильно зависит от их концентрации.
Биоинформатика и молекулярное моделирование могут быть полезными инструментами для изучения влияния концентрации реагентов на скорость биохимических реакций. Они позволяют анализировать взаимодействие атомов и углеводородов, энергию и параметры реакций, а также исследовать особенности реакций и пространственную структуру ферментов и их взаимодействие с субстратами и ингибиторами.
Температурный эфект на скорость реакции также связан с концентрацией реагентов. При повышении температуры скорость реакции обычно увеличивается, поскольку молекулы движутся быстрее и, следовательно, частота столкновений между реагирующими молекулами также возрастает.
Роль температуры в кинетике биохимических процессов
Температура играет важную роль в кинетике биохимических процессов, поскольку она оказывает значительное влияние на скорость биохимической реакции. При повышении температуры молекулы реагентов быстрее движутся, что увеличивает вероятность их взаимодействия и увеличивает скорость реакции.
Взаимодействие температуры и скорости биохимических реакций может быть описано с помощью уравнения Аррениуса. Уравнение Аррениуса связывает скорость реакции с температурой и энергией активации:
v = k * e-Ea/RT
Где v — скорость реакции, k — константа скорости, Ea — энергия активации, R — универсальная газовая постоянная, T — температура в Кельвинах.
Влияние температуры на скорость реакции
При повышении температуры энергия молекул реагентов увеличивается, что приводит к ускорению кинетических процессов. С ростом температуры, скорость реакции увеличивается, так как количество молекул с достаточной энергией для реагирования возрастает.
Таблица 1 показывает зависимость скорости реакции от температуры для биохимической реакции:
| Температура | Скорость реакции |
|---|---|
| 20 ℃ | 0.05 сек-1 |
| 30 ℃ | 0.10 сек-1 |
| 40 ℃ | 0.20 сек-1 |
Из таблицы видно, что с увеличением температуры скорость реакции возрастает.
Механизм регуляции биохимических процессов температурой
Температура имеет важное значение для регуляции биохимических процессов в живых системах. Они подвержены воздействию физико-химических параметров и взаимодействию с окружающей средой.
Например, катализ биохимических реакций может происходить с использованием различных ферментов, которые могут быть активны только при определенных температурах.
Другим примером является изучение влияния температуры на свойства ферментов, таких как коэффициенты ингибиторов, порядки реакции, порядок моделей Михаэлиса-Ментен и других параметров.
Вещества, растворенные в живых системах, могут также менять свои свойства в зависимости от температуры. Например, в процессе растворения углеводородов, увеличение температуры может значительно увеличить скорость процесса.
Таким образом, изучение роли температуры в кинетике биохимических процессов позволяет лучше понять механизм реагентов и регуляцию биохимических процессов в целом. Это знание может быть полезно для применения в спектрофотометрии, анализе данных и других областях биохимических исследований.
Катализаторы и их влияние на скорость биохимических реакций
Катализаторы играют ключевую роль в регуляции скорости биохимических реакций. Эти вещества способны ускорять реакцию без расхода самих себя, что делает их незаменимыми во многих процессах как в природе, так и в промышленности.
Одним из примеров катализатора является фермент, который исполняет важную роль в биологической системе, регулируя реакции, связанные с обменом веществ. Катализаторы, такие как ферменты, имеют специфичность к определенным субстратам и на последующих стадиях реакции контролируют скорость превращения одних веществ в другие.
Существуют различные факторы, влияющие на кинетические характеристики биохимических реакций. Таблица коэффициентов активации позволяет оценить, какой-либо фактор влияет на скорость реакции.
1. Температура. При повышении температуры реакционная активность увеличивается. Взаимодействие катализатора с субстратом на кинетическом уровне требует определенной энергии активации. Высокая температура позволяет преодолеть энергетический барьер и ускоряет процесс.
2. Концентрации и давлению реагирующих веществ. Изменение концентраций реагентов или воздействие давления влияет на скорость реакции.
3. Спектрофотометрия. Этот метод позволяет изучать кинетические характеристики реакции, определяя изменение оптических свойств веществ в процессе реакции.
В промышленности катализаторы нашли широкое применение, особенно в процессе синтеза органических соединений и разложении углеводородов. Имеются различные виды катализаторов, включая кристаллические вещества, растворы и гетерогенные системы.
Изучение кинетических свойств реакций и факторов, на них влияющих, имеет практическое значение. Знание химической и биологической кинетики позволяет контролировать реакции и оптимизировать условия для получения желаемых продуктов.
В целом, катализаторы играют важную роль в биохимических реакциях, влияя на скорость и эффективность протекания процесса. Изучение и использование катализаторов является основой в создании моделей и разработке новых методов в биологических и химических исследованиях.
Принципы и механизмы кинетических моделей биологических процессов
В кинетике биохимических реакций модели используются для изучения скорости и механизма этих процессов. Они позволяют описать изменение концентраций веществ, участвующих в реакции, в зависимости от времени. Изучение кинетики биохимических реакций имеет важное практическое значение, например, для медицинской диагностики, маркировки биохимических соединений, контроля за ферментативной активностью или изучения основных принципов обмена веществ.
В основе кинетических моделей лежит закон скоростей реакции. Закон скоростей описывает зависимость скорости реакции от концентраций веществ, катализирующих реакцию. Порядок реакции — это сумма показателей степени входящих в реакцию реагентов. Например, реакция первого порядка имеет порядок 1, реакция второго порядка — порядок 2, а реакция нулевого порядка не зависит от концентраций реагентов.
Механизм реакции описывает последовательность этапов, приводящих к образованию продукта. В биохимических реакциях механизмы катализируют ферменты, такие как фолиевая кислота или другие ферменты. Для исследования и контроля кинетики биохимических реакций используются различные модели и методы.
Взаимодействие между молекулами результата реакций и ферментом определяет скорость реакционной системы. Влияющие факторы на скорость биохимической реакции включают концентрации реагентов, температуру, наличие ингибиторов или активаторов, а также давление газов в реакционной смеси. При этом энергия активации молекулярного комплекса пропорционально концентрации ферментативно активного центра фермента.
Для описания кинетической модели биохимической реакции можно использовать уравнение, которое определяет скорость реакции. Изучение механизма реакции позволяет рассчитать время полураспада биохимической реакции и предсказать скорость этого процесса.
Примеры кинетических моделей биохимических процессов включают модели разложения углеводородов в газовой фазе, модели реакций с кислородом или другими реагентами, а также модели, используемые для изучения скорости ферментативных реакций. Кинетические модели позволяют определить вероятность определенного результата реакции, сколько времени займет этот процесс и какие факторы могут контролировать скорость реакции.
В итоге, принципы и механизмы кинетических моделей биохимических процессов играют важную роль в изучении скорости и механизма этих реакций. Они позволяют понять, какие факторы влияют на скорость реакции, какому закону она подчиняется, а также предсказать и контролировать эти процессы.
Возможные ограничения и предположения кинетических моделей

Реагенты могут влиять на скорость реакции, взаимодействуя с ферментом и изменяя его активность. Например, некоторые реагенты могут прямо взаимодействовать с ферментом, изменяя его конформацию и тем самым влияя на его активность. Также реагенты могут взаимодействовать с активным центром фермента, блокируя доступ к субстрату и замедляя скорость реакции.
Ингибиторы, в свою очередь, могут влиять на скорость реакции, препятствуя связыванию субстрата с ферментом и тем самым снижая его активность. Ингибиторы могут связываться с активным центром фермента, конкурируя с субстратом за связывание, или связываться с другими участками фермента, меняя его конформацию и тем самым затрудняя связывание субстрата.
2. Кинетика ферментативных процессов: механизмы и условия протекания.
Скорость ферментативных реакций может быть описана кинетическими моделями, такими как модель Михаэлиса-Ментен. Эта модель предполагает, что скорость реакции пропорциональна концентрации субстрата и зависит от его аффинности к ферменту.
Кинетические модели часто предполагают, что реакция протекает при определенных физико-химических условиях, таких как определенная температура и pH-значение. Если эти условия не соблюдаются, то скорость реакции может изменяться или реакция может вообще не протекать. Изменение температурных условий и pH-значения может оказывать влияние на активационную энергию реакции и, следовательно, на скорость реакции.
Предположения кинетических моделей могут быть упрощены, чтобы лучше соответствовать определенным условиям и исходным данным. Например, в некоторых случаях можно предположить, что концентрация фермента постоянна и не меняется в течение реакции.
Биоинформатика и молекулярная маркировка могут использоваться для изучения протекания биохимических реакций. Биоинформатика позволяет исследовать особенности структуры и взаимодействия фермента и субстрата, а молекулярная маркировка позволяет отслеживать изменения в структуре фермента и субстрата в процессе реакции.
Промышленность и медицинская биотехнология часто интересуются возможностью контролировать скорость биохимических процессов. Например, в промышленности может быть важно увеличить скорость реакции для повышения производительности, а в медицине — контролировать скорость реакций для достижения желаемого эффекта лечения.
Примеры применения кинетических моделей в изучении биохимических процессов
Кинетические модели в изучении биохимических процессов имеют практическое применение и позволяют лучше понять и контролировать химические реакции, происходящие в организмах. Рассмотрим несколько примеров применения этих моделей.
Моделирование скорости биохимической реакции
При изучении биохимических реакций важно понять, как изменение концентраций реагентов влияет на скорость протекания процессов. Кинетические модели позволяют описать эту зависимость и определить факторы, влияющие на скорость реакции.
Например, при исследовании влияния концентрации фолиевой кислоты на скорость реакции катализируемой фолиатредуктазой, можно построить математическую модель, учитывающую зависимость скорости реакции от концентрации фолиевой кислоты. Это позволяет определить оптимальные условия для проведения реакции.
Моделирование энергии активации реакции
Кинетические модели также используются для описания энергетических характеристик химической реакции. Одна из особенностей биохимических процессов заключается в том, что они протекают в присутствии биологической системы, которая катализирует реакции. Кинетическая модель, основанная на законе Аррениуса, позволяет оценить энергию активации реакции и установить ее зависимость от температуры.
Например, при изучении процессов окисления водорода с помощью изотопных методов можно использовать кинетическую модель, учитывающую зависимость скорости реакции от концентрации водорода и катализирующего фермента. Это позволяет более точно определить кинетику данной реакции и выявить ее особенности.
Моделирование реакций в медицинской биохимии
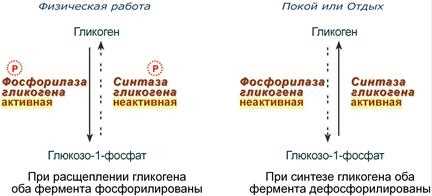
В медицинской биохимии кинетические модели используются для изучения реакций, происходящих в организме. Например, при исследовании влияния препаратов на активность ферментов можно использовать модели, которые позволяют определить пропорциональность между концентрацией препарата и скоростью реакции. Это помогает разработать эффективные лекарственные препараты и оптимизировать их дозировку.
Таким образом, кинетические модели играют важную роль в изучении биохимических процессов. Они позволяют глубже понять законы и основы химических реакций, а также предоставляют инструменты для более точного моделирования и анализа сложных биологических систем.

0 Комментариев