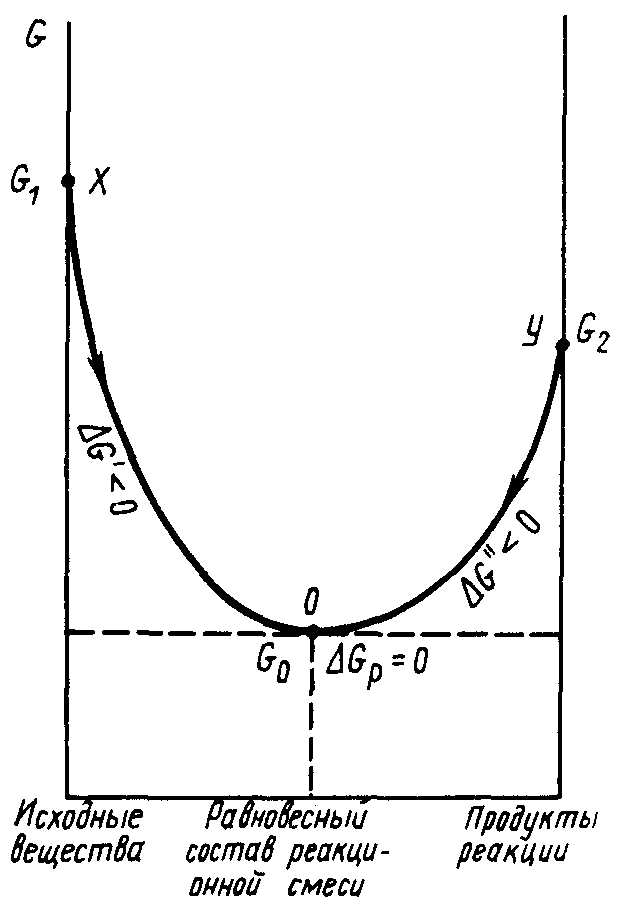
Химическое сопряжение биохимических реакций является основой многих процессов, происходящих в организмах живых существ. Благодаря этому принципу удается поддерживать равновесие между протекающими реакциями и сохранять необходимую энергию для жизнедеятельности. Основой такого сопряжения является энергетический разрыв между прямой и обратимой реакциями, который обеспечивает возможность накопления энергии и использования ее в других биохимических процессах.
Реакции, имеющие обратимую энергетическую связь, называются сопряженными. Они осуществляются с участием специальных ферментов, которые позволяют изменять направление реакции и удерживать систему в равновесии. Константа равновесия для таких реакций является показателем энергетической эффективности процессов.
Одним из примеров сопряжения биохимических реакций является гидролиз АТФ (аденозинтрифосфата). При гидролизе АТФ устраивается обратимая реакция, в результате которой энергия, освобожденная при разрыве фосфоангидридных связей, сопрягается с эндергоническими процессами. В итоге, АТФ превращается в АДФ (аденозиндифосфат) и накопленная энергия может быть использована в других биохимических реакциях.
Принцип энергетического сопряжения в биохимических реакциях
Принцип энергетического сопряжения
В химической системе реакции происходят при установлении равновесия между реагентами и продуктами. Равновесное состояние характеризуется равенством скоростей прямой и обратной реакций, а также постоянством концентраций реагентов и продуктов в системе. Но в биохимических реакциях есть реакции, которые не могут протекать в прямом направлении без энергетического сопряжения. Эти реакции, которые требуют энергии для совершения превращений, называются обратимыми.
Каталитический аспект принципа энергетического сопряжения состоит в том, что энергия, выделяющаяся в ходе гидролиза стандартного вещества, смотреть таблицы константа равновесия, имеет возможность увеличить энергию активации для любой обратимой реакции в химической системе.
Механизм энергетического сопряжения
Гидролиз стандартного вещества и образование стандартных реагентов устанавливают принцип энергетического сопряжения в системе. Все эти реакции являются необратимыми и нуждаются в наличии катализатора для протекания. Кроме того, происходит связь энергии активации в этих реакциях с другими превращениями, что позволяет контролировать превращение различных веществ в системе.
Таким образом, принцип энергетического сопряжения в биохимических реакциях позволяет поддерживать энергетическое равновесие, обеспечивая энергию для протекания обратимых реакций и контролируя направление превращения веществ в химической системе.
Механизмы энергетического сопряжения
Механизмы энергетического сопряжения обратимых биохимических реакций основываются на принципе сохранения энергии. При обратимой реакции, энергия, выделяющаяся при разрыве связей в реагенте, может быть использована для эндергонического процесса в обратном направлении. Таким образом, энергия не теряется, а уходит на приведение в действие других реакций.
Катализаторы играют важную роль в механизмах энергетического сопряжения. Они ускоряют скорость реакций, уменьшая энергетический барьер и позволяя реакции протекать эффективнее. В обратимых реакциях, катализаторы также облегчают переход обратно к равновесию, ускоряя обратные реакции и обеспечивая баланс энергии.
В механизмах энергетического сопряжения важным моментом является установление состояния равновесия между прямыми и обратными реакциями. Состояние равновесия характеризуется концентрациями реагентов и продуктов и имеет связь с освобождением или поглощением энергии. Обратимые реакции, в которых константа равновесия отлична от нуля, можно использовать для установления энергетического равновесия в системе и перераспределения энергии между различными процессами.
Таким образом, механизмы энергетического сопряжения в биохимических реакциях необходимы для эффективного использования энергии, полученной в одних реакциях, в других процессах. Принцип сохранения энергии, обратимые реакции, катализаторы и установление равновесия являются основными механизмами сопряжения энергии в биохимических системах.
Химическое равновесие в биохимических реакциях
В биохимических реакциях принцип энергетического сопряжения играет важную роль. Большинство биохимических реакций протекают обратимо, то есть продукты реакции могут разлагаться обратно на исходные вещества. Эти обратимые реакции имеют связь с принципом энергетического сопряжения.
Процессы в этих реакциях протекают при участии катализатора, что позволяет снизить активационную энергию и ускорить реакцию. Реакции, в которых происходит разрыв химической связи и образуются другие вещества, называются реакциями гидролиза.
Химическое равновесие в биохимических реакциях устанавливается при прямой и обратной реакции, которые происходят одновременно. Причем любая реакция имеет свою равновесную константу, которая характеризует состояние равновесия системы.
Равновесные состояния в биохимических реакциях являются необратимыми, то есть они устойчивы и не изменяются при изменении условий реакции. В равновесных состояниях энергия энергетического сопряжения уменьшает свою стандартную энергию.
Биохимические реакции, при которых происходит установление равновесия энергетического сопряжения, происходят под влиянием различных факторов, таких как концентрация веществ, температура, наличие катализатора и других.
Обратимые и необратимые реакции
Основной принцип обратимости химических реакций заключается в том, что при достижении равновесного состояния концентрации и скорости обратной и прямой реакций становятся равными. Такое равновесие может смотреться как разрыв реакций, в котором все происходящие химические реакции являются обратимыми.
Взятыми из стандартного словаря химической терминологии, образом, обратимые реакции называются равновесными реакциями. Равновесие — это состояние системы, при котором концентрации и скорости обратной и прямой реакций остаются постоянными.
Причем, энергетическое состояние системы в равновесии имеет особую связь с принципом энергетического сопряжения биохимических реакций. В таких системах энергия необратимых реакций может быть уменьшена за счет потери энергии при установлении равновесия.
Сопряжение энергетического принципа и равновесия всех реакций в биохимии указывает на то, что обратимые реакции играют важную роль в установлении энергетического сопряжения между различными химическими превращениями. При этом константа равновесия является показателем энергии, связанной с равновесными состояниями системы.
Обратимые реакции сопрягаются с другими реакциями, избыток энергии от которых используется для энергетического сопряжения. В то же время, необратимые реакции сопрягаются с обратимой реакцией гидролиза, что позволяет использовать энергию продуктов гидролиза для установления энергетической связи с другими необратимыми реакциями.
Таким образом, обратимые и необратимые реакции играют важную роль в энергетическом сопряжении биохимических реакций. Они связаны между собой через равновесные состояния, константы равновесия и потерю или установление энергии при протекании этих реакций.
Константа равновесия и ее значение
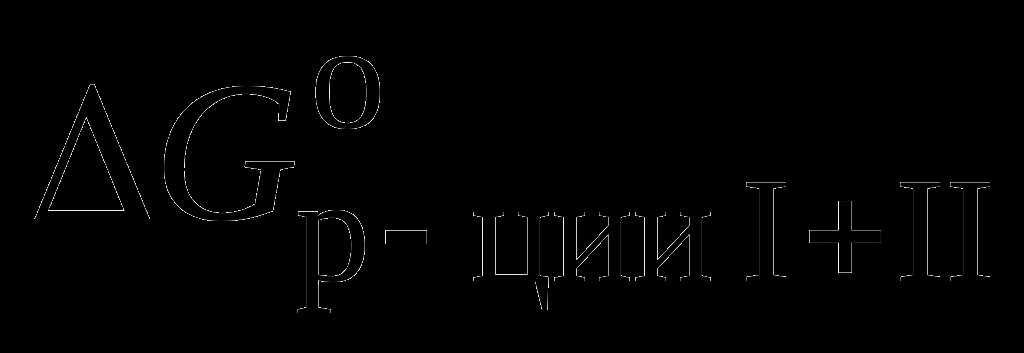
Значение константы равновесия показывает, в какой степени равновесие смещено в сторону продуктов или реагентов. Если значение Keq больше 1, то равновесие смещено в сторону продуктов, а если значение Keq меньше 1, то равновесие смещено в сторону реагентов.
Константа равновесия можно также интерпретировать как отношение скоростей прямой и обратной реакций. Если значение Keq больше 1, то скорость прямой реакции превышает скорость обратной реакции, и наоборот.
Константа равновесия и энергетическое сопряжение
Принцип энергетического сопряжения биохимических реакций основан на том факте, что энергия, выделяемая в ходе реакций, может быть использована для протекания других реакций. Реакции, у которых энергия выделяется возвращается обратно в систему и используется для установления равновесия, называются обратимыми.
Существуют также необратимые реакции, при которых энергия выделяется в виде тепла или других форм энергии и не возвращается обратно в систему. Они характеризуются большими значениями константы равновесия Keq.
Принцип энергетического сопряжения и катализаторы
Принцип энергетического сопряжения также применим к взаимодействию реакций с катализаторами. Катализаторы ускоряют реакции, изменяя механизм их протекания, но при этом не изменяют константу равновесия.
Катализаторы могут повышать скорость только прямой реакции, уменьшая энергию активации. Они не влияют на концентрации продуктов и реагентов в состоянии равновесия.
Принцип энергетического сопряжения в других словарях
1. Понятие «энергетическое сопряжение»
Энергетическое сопряжение — это связь между двумя или более реакциями, где энергия, выделяемая в одной реакции, используется в другой. Такое сопряжение позволяет привести каталитическую реакцию в состояние равновесия или обратимые реакции, что является основой для поддержания химического равновесия в биохимических системах.
2. Реакции гидролиза
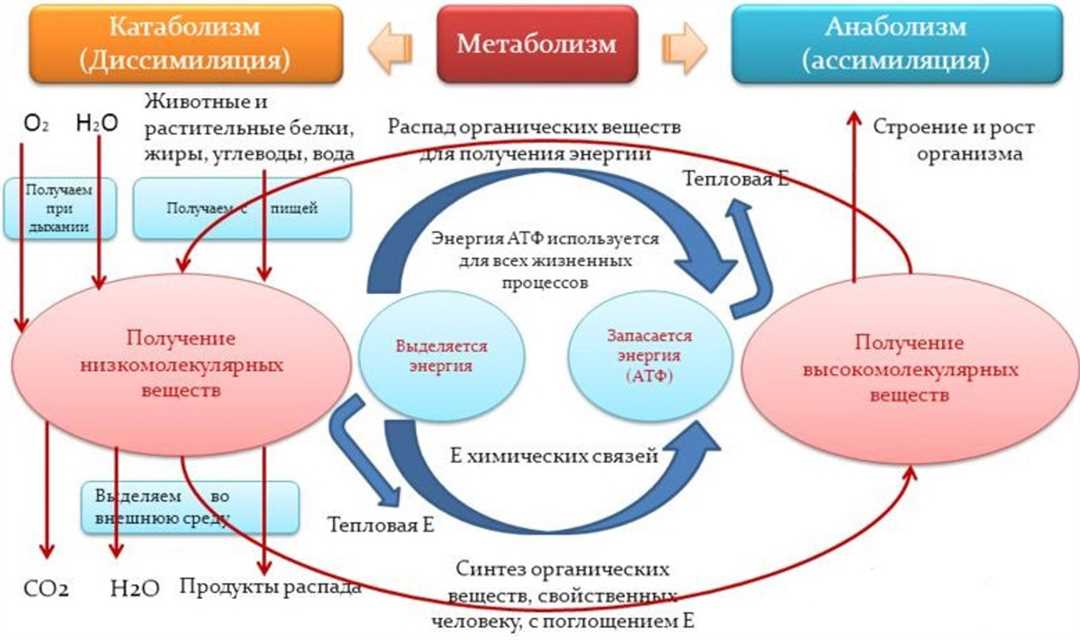
Реакции гидролиза — это химические реакции, в которых молекулу разрывают на две части с участием воды. Такие реакции часто происходят в биохимических системах и являются одним из примеров энергетического сопряжения, где энергия, выделяемая при гидролизе, используется для выполнения других биохимических процессов.
3. Равновесие в системе
Равновесие — это состояние системы, в котором прямая и обратная реакции происходят с одинаковой скоростью. Равновесие в химической реакции обычно характеризуется константой равновесия, которая зависит от концентраций реагентов и продуктов в системе. В энергетическом сопряжении биохимических реакций, равновесные реакции являются обратимыми и имеют катализаторы, которые ускоряют скорость процессов.
4. Принцип энергетического сопряжения
Принцип энергетического сопряжения заключается в том, что энергия, выделяемая в необратимых реакциях, используется для протекания обратимых реакций. Такой принцип является основой для поддержания биохимических процессов и установления равновесия в системе.
Это лишь некоторые из терминов, которые можно встретить в словарях при изучении принципов энергетического сопряжения в биохимических реакциях. Смотреть подобные определения может помочь увидеть общую картину и лучше понять этот принцип.

0 Комментариев