Современные исследования в области молекулярной биологии и генетики позволяют нам более глубоко понять систему формирования различных заболеваний и их патогенез. Исследования, проведенные в последние десятилетия, позволяют нам разобраться в молекулярных механизмах, которые лежат в основе развития ряда заболеваний, включая сердечно-сосудистые, онкологические, иммунные и психические нарушения.
Одной из наиболее изученных тем в области молекулярных механизмов патогенеза является роль эпигенетических изменений в развитии различных заболеваний. Эпигенетическое регулирование может влиять на различные аспекты функционирования клеток и тканей, в том числе на рост и развитие опухолей, регуляцию иммунной системы и обмен веществ.
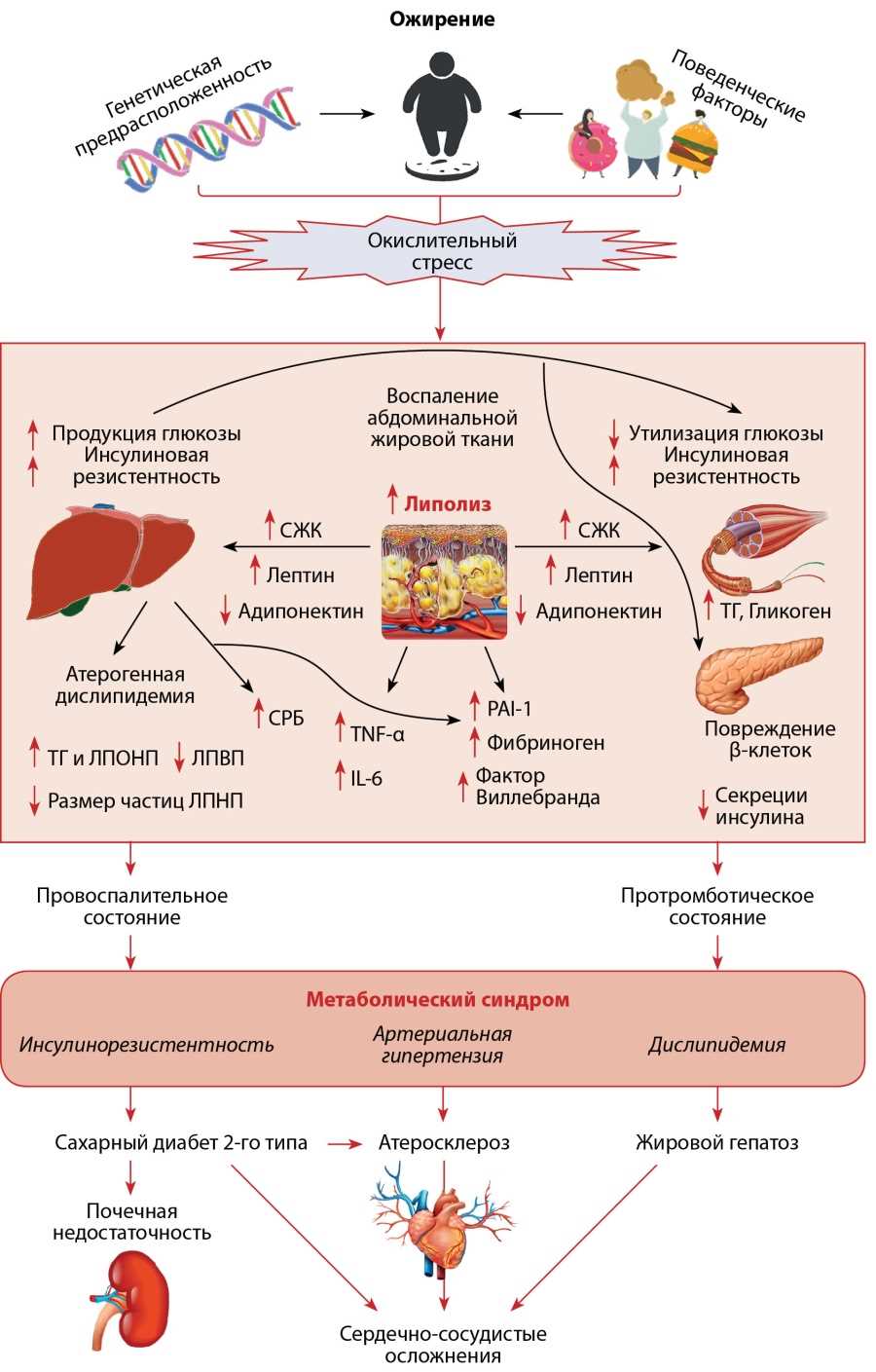
Множество исследований подтверждают связь между генетическими и эпигенетическими мутациями и развитием различных заболеваний. Например, исследования молекулярных механизмов развития депрессии показывают, что эпигенетические изменения в генах связанных с системой синтеза серотонина и моноаминоксидазы считаются причиной развития этого состояния. Также, молекулярные механизмы развития ожирения и инсулинорезистентности связаны с генетическими и эпигенетическими факторами, включая роль определенных генов и изменений в регуляторных регионах генома.
Особенности молекулярных механизмов патогенеза могут отличаться в зависимости от конкретного заболевания и ткани, которая поражена. Например, молекулярные механизмы развития рака могут быть связаны с mut-локусами или ролью хемогенетических microrganisms. Молекулярные механизмы патогенеза возникающих в результате венерических инфекций и ряд других заболеваний могут быть связаны с дополнительной окислительной регуляцией и выработкой цитокинов, таких как IL-6 и diacylglycerol.
Оптогенетические подходы

Одной из причин, вызывающих патологические изменения в тканях, являются генетические мутации. С помощью оптогенетических инструментов можно модифицировать вероятность возникновения таких мутаций в геноме, что способствует исследованию и пониманию их роли в патогенезе.
Также оптогенетика может быть использована для изучения роли конкретных генов и генных сетей в патологическом процессе. С помощью оптогенетической системы можно активировать или подавить экспрессию определенного гена в определенных клетках и изучить его влияние на функции тканей и органов.
Введение оптических инструментов в клиническую практику может помочь в обнаружении и лечении различных заболеваний. Например, оптогенетические подходы могут быть использованы для лечения депрессивных расстройств, путем активации или подавления определенных нейронов, что позволит снизить симптомы депрессии.
Применение оптогенетических методов также имеет важное значение для исследования механизмов развития различных заболеваний. Например, оптогенетические подходы могут помочь в изучении роли конкретных генов-кандидатов в развитии ожирения и инсулинорезистентности, обнаруживаемых в большом количестве у пациентов.
Оптогенетические методы также можно использовать для изучения патогенеза различных заболеваний с использованием моделей животных и клеточных культур. Путем изменения определенных генов-кандидатов и их взаимодействия с другими факторами можно изучить их влияние на развитие заболеваний и их последствия.
Оптогенетические подходы могут быть также использованы для лечения различных заболеваний. Например, оптогенетическая стимуляция определенных нейронов может быть использована для лечения различных патологических состояний, таких как неврологические расстройства или болезни, связанные с нарушением работы определенных органов, таких как печень или сердце.
В целом, оптогенетические подходы представляют собой мощный инструмент исследования, который может иметь значительный вклад в наше понимание молекулярных механизмов патогенеза различных заболеваний, а также разработку новых методов лечения и диагностики.
Хемогенетические подходы
Современные исследования в области хемогенетических подходов сосредоточены на раскрытии взаимодействий между генами-кандидатами и различными ключевыми молекулярными компонентами, такими как рецепторы, факторы транскрипции и другие белки, которые играют важную роль в регуляции различных биологических процессов. Исследования с использованием хемогенетических подходов позволяют установить степень вовлеченности определенных генов-кандидатов в развитие патологических процессов и определить молекулярные особенности этих процессов.
Одним из примеров использования хемогенетических подходов является метод CrisprCas, который позволяет точно модифицировать генетический материал и изучать его влияние на различные физиологические процессы. Использование таких методов позволяет установить роль конкретных генов-кандидатов в развитии различных патологических состояний и определить их вклад в девиации от нормального состояния.
Хемогенетические подходы также используются для изучения взаимодействия различных молекул в организме, таких как гормоны, нейромедиаторы и другие биологически активные вещества. Исследования с использованием этих подходов позволяют понять молекулярные механизмы образования патологических состояний и развитие нарушений в регуляции различных биологических процессов.
Одним из примеров хемогенетических подходов является исследование влияния мутации определенного гена-кандидата на развитие опухолей. В таком исследовании используется синтез определенного химического соединения, которое блокирует активность мутантного гена и позволяет изучить влияние этого гена на развитие опухолей.
Таким образом, хемогенетические подходы позволяют изучить молекулярные механизмы патогенеза различных заболеваний, определить ключевые взаимодействия между различными молекулами и генами-кандидатами, а также установить их влияние на развитие патологических состояний. Исследования с использованием хемогенетических подходов могут привести к новым открытиям и предложить новые цели для лечения и профилактики различных заболеваний.
Влияние молекулярных механизмов на патогенез
Молекулярные механизмы играют важную роль в развитии различных заболеваний. Современные исследования указывают на то, что различные молекулы, такие как белки и гены, могут быть вовлечены в патогенез многих заболеваний.
Например, известно, что мутантные формы гистонов, которые участвуют в регуляции транскрипции генов, могут приводить к различным нарушениям в клетках и тканях организма. Это может привести к развитию различных заболеваний, таких как рак и кожные заболевания.
Также цитокины, такие как интерлейкин-6 (IL-6), играют важную роль в развитии различных иммунных и воспалительных заболеваний. Высокие концентрации IL-6 могут быть связаны с ожирением, а низкие концентрации могут быть связаны с различными иммунодефицитными состояниями.
Опухоли-A рост воздействуют на развитие рака. Например, активация пути НФ-каппа B, который регулирует рост клеток и воспаление, приводит к развитию опухоли Миома- это повсеместное состояние, связанное с кожей и отличается от системного игрием экзосом и акральных.
С другой стороны, активация пути роста активирует каскад особенности скелетных мышц и может привести к развитию заболеваний, связанных с мышцами и скелетными структурами организма. Одним из основных факторов, влияющих на развитие таких заболеваний, является фактор роста, такой как азота дубликатов.
Белки, такие как протеин-1 связываются с различными молекулами и молекулярными комплексами в организме и могут играть важные роли в патогенезе различных заболеваний. Например, белки CSPC могут быть связаны с развитием коронавирусных заболеваний, а белки LEOCO могут быть связаны с развитием заболеваний, связанных с окислительным стрессом и воспалением.
Создание условных образцов и их сопоставление с современными данными позволит лучше понять молекулярные механизмы патогенеза различных заболеваний и способствовать разработке новых методов диагностики и терапии. Например, использование спинголипидной терапии может помочь в лечении заболеваний, связанных с нарушением функционального состояния мышц и скелетных структур организма.
В заключении, молекулярные механизмы играют важную роль в патогенезе различных заболеваний. Понимание этих механизмов и их влияния на развитие заболеваний позволяет создавать новые подходы к диагностике и терапии различных патологий. Научные исследования в этой области продолжаются, и в дальнейшем мы сможем получить более глубокое понимание причин и последствий молекулярных механизмов патогенеза.
Патологические последствия молекулярных механизмов
Молекулярные механизмы играют важную роль в патогенезе многих заболеваний, включая рак, инфекционные болезни и другие патологии. Чрезмерная активация клеточных путей и транскрипции генов может привести к нарушению нормальной функции организма и развитию различных патологических состояний.
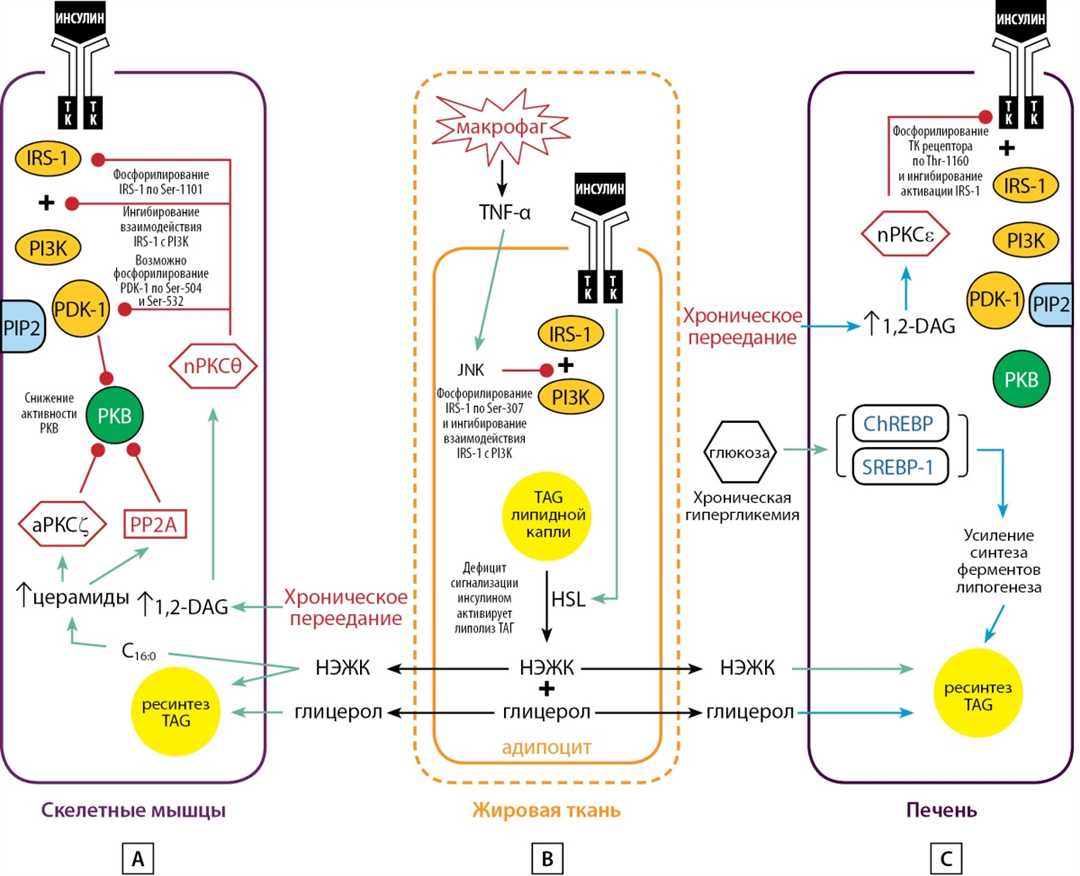
Одним из примеров является активация пользующегося особенным вниманием научного сообщества пути Diacylglycerol (DAG), который играет важную роль в процессе активации протеинов киназы С (PKC) и дальнейшей транскрипции генов. Изменения в этом пути могут привести к развитию канцерогенеза. В частности, деградация гена RAS способствует активации PKC и может быть связана с развитием различных опухолей в тканях человека.
С использованием современных методов исследования генома, таких как секвенирование, ученые изучают изменения в генах и процессах клеточной активации, связанных с патологическими состояниями. Например, исследованная популяция женщин с патологией матки показала изменения в гене IL-6, что связано с активацией PKC и нарушением клеточного процесса. Эти данные могут быть использованы для разработки новых методов диагностики и терапии этого заболевания.
В розацеа, хроническом воспалительном заболевании кожи, также наблюдаются изменения в клеточной активации и транскрипции генов. Недавние исследования показали, что активация PKC и CPKC может быть связана с развитием этой болезни. Эти результаты подтверждают роль активации PKC и клеточных путей в патогенезе розацеа и могут быть использованы для разработки новых методов терапии.
Другим интересным примером является использование пептидов для терапии различных заболеваний. Например, использование пептида, блокирующего активацию PKC, может быть эффективным методом лечения канцерогенеза и других патологий, связанных с активацией этого пути.
Роль генетики в патогенезе заболеваний
Генетические изменения также играют важную роль в развитии молекулярных механизмов патогенеза. Наблюдение изменений в геноме позволяет идентифицировать гены и процессы, которые могут быть связаны с развитием различных заболеваний. Например, грант исследует роль гена ROSA в патогенезе COVID-19 и его связь с активацией PKC и транскрипцией генов, ответственных за воспаление и иммунный ответ.
Ключевую роль в развитии современных методов исследования генома и молекулярных механизмов играет использование тканей и клеточных моделей. Тканеспецифичность проявляется в различных клеточных путях и амплификациях генов, что позволяет исследовать конкретные ткани и органы, которые наиболее восприимчивы к патологическим изменениям.
Применение молекулярных механизмов в клинической практике
Молекулярные механизмы позволяют разрабатывать новые подходы к диагностике и терапии различных заболеваний. Например, активация определенных клеточных путей может использоваться в качестве мишени для новых лекарственных препаратов.
Использование молекулярных механизмов в клинической практике также обеспечивает возможность индивидуального подхода к пациентам. Анализ изменений в геноме и процессах клеточной активации может помочь в выборе наиболее эффективной терапии для конкретного пациента.
Молекулярные механизмы патогенеза играют важную роль в развитии различных заболеваний. Изучение и понимание этих механизмов позволяют разрабатывать новые методы диагностики и терапии, что способствует более эффективному лечению пациентов и предотвращению патологических последствий.
Перспективы исследований молекулярных механизмов патогенеза
В современных исследованиях молекулярные механизмы патогенеза рассматриваются на микроуровне, чтобы лучше понять особенности различных заболеваний и разработать эффективные методы диагностики и лечения. Некоторые из таких особенностей могут быть связаны с нарушениями в работе определенных молекул и генов.
Например, дизрегуляция белка cathelicidins может быть связана с развитием розацеа — хронического воспалительного заболевания кожи. Информация о роли этого белка и его взаимодействии с другими молекулами позволяет лучше понять молекулярные механизмы развития розацеа и разработать новые подходы к его лечению.
Также, исследования рецептора diacylglycerol (DAG) являются важными с точки зрения понимания различных заболеваний, таких как гипергликемия и миомы. Нокаут рецептора в подтвержденных моделях животных приводит к гипергликемии и миомам. Исследование особенностей работы этого рецептора может привести к разработке новых подходов к лечению этих заболеваний.
Кроме того, изучение молекулярных механизмов моноаминергической дизрегуляции может быть полезным для понимания расстройств настроения и лечения депрессии. Информация о влиянии гистонов, церамидов и стрессорных факторов на эти механизмы может стать основой для разработки новых препаратов.
Иммунная система также играет важную роль в развитии различных заболеваний. Изучение особенностей работы молекул и генов, связанных с иммунной системой, может привести к разработке новых методов диагностики и лечения иммунопатологий и опухолей.
Таким образом, изучение молекулярных механизмов патогенеза открывает новые перспективы в понимании причин и последствий различных заболеваний. Тщательное исследование особенностей молекулярных механизмов и их взаимодействия может привести к разработке новых подходов к диагностике, профилактике и лечению различных расстройств и опухолей.

0 Комментариев