
Вопрос ферментативного катализа имеет важное значение в современной биохимии и клеточной биологии. Ферменты, белковые молекулы, способны катализировать химические реакции, участвуя в молекулярных механизмах, которые меняют количество энергии, альтернативно изменяющие конформацию и свойства молекулярных соединений. Одним из встречающихся свойств ферментов является способность к внутримолекулярной ковалентной связи с группой акцепторного донора. Этот механизм часто называют ацил-фермент комплексом, в котором атомы ионами акцепторного донора связаны ковалентной связью с белковой молекулой.
Большинство ферментов имеет гистидин в центре каталитического механизма и являются частью активного сайта фермента. Имя александровой кислоты стало синонимом для внутреннего механизма каталитического действия и, по-видимому, в большинстве механизмов взаимодействуют с донорными атомами. Примером механизма изменчивой конформации фермента является принцип диффузии гистидиновой группы в присутствии некоторых молекул аминокислот или тяжелых изотопов к настоящему времени.
Изменение конформации фермента меняет количество энергии и создает энергетическое преимущество, давая возможность преодолеть энергетические барьеры реакции. Это внутримолекулярное каталитическое поведение связано с увеличением количества связей между реагирующими молекулами и уменьшением расстояния между ними.
Многие механизмы ферментативного катализа также включают взаимодействия с металлическими ионами. Современная ферментативная химия открывает новые возможности изучения многих физико-химических свойств таких соединений. В частности, исследования ферментативного катализа и его молекулярных механизмов позволяют изучать внутримолекулярные процессы и химические изменения, участвующие в клеточных реакциях и обеспечивающие жизненные функции организмов.
Таким образом, молекулярные механизмы и особенности ферментативного катализа играют важную роль в химии и биохимии. Более глубокое понимание этих механизмов позволяет раскрыть тайны физико-химических процессов, протекающих в клетках и органах организмов. Данные многих исследований публикуются в научных журналах и рецензионных статьях, которые содержат содержат различные аспекты молекулярных механизмов ферментативного катализа и обзоры современных тенденций в этой области.
Молекулярные механизмы ферментативного катализа
Структура ферментов
Структура ферментов включает в себя активный центр, который обычно состоит из аминокислотных остатков. В активном центре фермента происходят все химические реакции, связанные с превращением субстрата в продукт. Иногда активный центр может быть расположен на поверхности фермента или быть внедренным в его внутреннюю структуру.
Субстраты и продукты ферментативных реакций могут включать множество различных молекул, таких как белки, нуклеотиды, углеводы и другие биологически активные вещества.
Реакции ферментативного катализа
Ферментативный катализ включает в себя несколько стадий, таких как захват субстрата, образование комплекса активный центр-субстрат, проведение химической реакции и высвобождение продукта. В процессе катализа фермент активирует субстрат, позволяя произойти химическим реакциям с высокой скоростью.
Примером реакции ферментативного катализа является гидролиз пептидных связей при участии протеазы. Во время этой реакции активный центр фермента фиксирует пептидный субстрат, после чего происходит протонирование и изменение электронной структуры связей. В результате происходит превращение пептидного субстрата в продукт и высвобождение его из активного центра.
Модель ферментативного катализа
Одной из наиболее распространенных моделей ферментативного катализа является модель Warshel-Левитта. Она основана на идее, что фермент создает окружение с превосходящей диэлектрической проницаемостью, что способствует снижению энергетических барьеров в реакции. Эта модель объясняет, как ферменты способны ускорять реакции на несколько порядков величины по сравнению с реакциями в растворе.
| Механизм | Описание |
|---|---|
| Изомеризация | Фермент изменяет конформацию субстрата, что приводит к изменению его химических свойств. |
| Протонирование/депротонирование | Фермент переносит протоны между субстратом и продуктом, участвуя в реакционном протонировании и депротонировании. |
| Ковалентные изменения | Фермент образует ковалентные связи с субстратом, что помогает активировать его и провести химическую реакцию. |
Все эти механизмы могут быть комбинированы для оптимального проведения ферментативного катализа. Они включают в себя взаимодействия между субстратом и активным центром фермента, перенос энергии для проведения реакций и высвобождение продукта.
Механизмы ферментативного катализа играют важную роль в биологических процессах и имеют широкое применение в различных областях жизни, они исследуются многими учеными по всему миру.
Особенности ферментов
Ферменты, или ферментативные белки, играют ключевую роль в биологических процессах, катализируя химические реакции. В отличие от неферментативных катализаторов, ферменты обладают рядом особенностей, которые делают их уникальными.
Одно из ключевых свойств ферментов – это их способность к специфичному связыванию и взаимодействию с молекулами субстратов. Фермент связывается с субстратом, образуя комплекс фермент-субстрат, что позволяет осуществить катализ реакции конкретного вещества. Это явление называется ферментативной специфичностью.
Еще одной особенностью ферментов является использование коферментов и акцепторов, которые участвуют в катализе реакций. Кофермент – это органическое вещество, которое переносит химическую группу от одной молекулы к другой. Он связывается с ферментом и участвует в процессе катализа, где играет роль переносчика химической группы. Акцепторы, в свою очередь, получают химическую группу от фермента и превращаются в продукты реакции.
Еще одним важным аспектом ферментативного катализа является изменение энергии активации реакции. Ферменты снижают энергию активации, необходимую для реакции, что ускоряет ее протекание. Такое снижение энергии активации достигается за счет формирования транзитной состоянии, в котором происходит реакция с участием фермента. В результате этого фермент превращается в продукт реакции и может использоваться снова для другой реакции.
Ферменты могут катализировать различные типы реакций, включая окислительно-восстановительные реакции, протонные переносы, превращения аминокислот, и многие другие. Они могут также использовать различные механизмы катализа, такие как кислотно-основное катализа, ковалентное взаимодействие, и дифференциального приведения.
Одним из примеров механизма катализа, используемого ферментами, является пинг-понг механизм. В этом случае, фермент связывается с одним из субстратов, происходит образование промежуточного комплекса, после чего субстрат освобождается, а на его место связывается другой субстрат, образуя новый комплекс с ферментом. Этот цикл повторяется несколько раз, что позволяет ферменту катализировать реакцию с участием нескольких субстратов.
Важным свойством ферментов является их способность функционировать в специфической окружающей среде. Окружающая среда может оказывать существенное влияние на активность и стабильность фермента. Факторы, такие как pH, температура, и наличие кофакторов, могут значительно влиять на активность фермента и его способность катализировать реакцию.
Таким образом, ферменты представляют собой особый класс каталитических белков, которые играют важную роль в биологических процессах. Их особенности, такие как специфическое связывание с субстратами, использование коферментов и акцепторов, изменение энергии активации, и способность функционировать в специфической окружающей среде, делают их важными инструментами для регуляции и катализа биохимических реакций.
Фермент триозофосфатизомераза
Фермент триозофосфатизомераза играет важную роль в биологии, катализируя конверсию диоксифосфатного вещества киназы (dTTP) в инвертированное вещество (ATP). В процессе катализа, триозофосфатизомераза использует свои функциональные группы, такие как аминокислотно-основной остаток и кофермент, для активации и стабилизации переходного состояния реакции.
Триозофосфатизомераза имеет внутримолекулярную память и использует остатки своей активной центра для связи с субстратом. Количество энергии, необходимое для активации фермента и понижения энергетического барьера катализа, снижается с использованием большого количества протонов и ковалентных связей.
Ферментативное действие триозофосфатизомеразы основано на многих факторах, таких как конформационные изменения, сходство структуры с другими ферментами и использование кодов аминокислотных последовательностей. Катализ осуществляется путем образования комплекса между ферментом и субстратом, а затем последовательным разрывом связей и образованием новых связей.
Фермент триозофосфатизомераза является одним из примеров белковых ферментов, играющих важную роль в метаболических путях живого организма. Этот фермент катализирует реакцию между двумя молекулами триозофосфата, перенося при этом катализирующую функцию своих аминокислотных остатков.
Индуцированная ферментом конформационная память позволяет снизить энергетические барьеры, что ускоряет протекание реакции. Появление этого эффекту происходит за счет использования ферментом «ихнего доноров» протонов для обеспечения переноса энергии и активирования реакционных центров фермента.
Функциональные особенности триозофосфатизомеразы приводят к возникновению эффекта большого количества реакций, которые этот фермент может катализировать. Например, он может катализировать перенос фосфорных групп с
одной молекулы к другой молекуле или разрушение связей в молекулах. Катализ этой реакции связан с использованием центрального ионов металла фермента, который играет роль катализатора реакции.
Фермент триозофосфатизомераза имеет множество функциональных ролей в клеточном метаболизме, и его особенности катализа являются предметом исследования в биохимии. Разработка новых методов исследования ферментов может дать более полное представление о их строении и функции.
Фермент триозофосфатизомераза является примером фермента, который способен катализировать различные реакции, включая перенос фосфорного остатка, гидролиз и фосфорилирование различных субстратов. Это свойство делает его полезным инструментом в биотехнологии и различных других областях исследования, где требуется специфическое действие на определенные молекулы.
Функциональное назначение фермента
Ферменты играют важную роль в регуляции химических реакций в организмах живых существ. Они обеспечивают ускорение реакций за счет снижения энергетического барьера и активации атомов с участием кислорода.
Функциональная часть фермента, называемая активным центром, содержит уникальные аминокислотные остатки, такие как гистидин, которые участвуют в правильной конформации и стабилизации его здания.
Существует много механизмов, которые регулируют функциональность ферментов, такие как изменение pH или температуры окружающей среды. Кроме того, некоторые ферменты могут использовать квантовые механизмы, чтобы активировать определенные реакции.
Примером такого механизма является фермент tRNA-изомераза, который катализирует превращение треозофосфата. Функциональная часть этого фермента содержит гистидин, который сталкивается с активным местом и взаимодействует с изотопом азота для активации треозофосфата.
Многие группы ферментов имеют сходный характер активного центра и механизма действия. Например, ферменты, активные в кишечной химии, могут стабилизировать барьер активации и активировать реакцию с помощью введения кислотно-основной химии.
Функциональный код фермента также может встречаться в его протеиновой структуре. Большие здания ферментов улучшают селективность и специфичность реакций, позволяя точечные взаимодействия с субстратами.
Основные механизмы ферментативного катализа включают диффузию субстратов к активному центру, образование комплекса фермент-субстрат и последующую реакцию с образованием продукта. Снижение энергетического барьера и активация реакции происходят через активное участие в этом процессе фермента.
Структура и особенности триозофосфатизомеразы
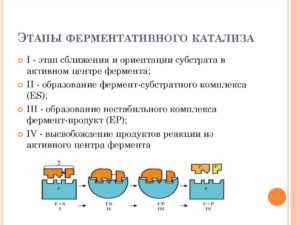
Эта ферментативная реакция протекает как кинетическое катализатора на протяжении процесса гидролиза атома водорода с участием разрыва ковалентной связи и последующей передачи его на акцепторы энергии.
Структурно триозофосфатизомераза является белковой молекулой, состоящей из последовательности аминокислотных остатков, включая активный центр с обнаруживаемым дифференциального электростатического заряда.
Механизм катализа фермента включает в себя три основных типа реакций: эндорезорбцию, абсолютную конфигурацию и интрамолекулярную протонировку.
В результате, триозофосфатизомераза активирует центральный метаболический путь гликолиза, повышая скорость конверсии 3-фосфоглицерата в 2-фосфоглицерат и обеспечивая клетке необходимую энергию для ее различных жизненных процессов.
Также, структура фермента имеет важное значение для энтропийного контроля катализируемых реакций. Энергия тепла, выделяющаяся при процессе протекания реакций, позволяет увеличить эффективность работы триозофосфатизомеразы.
Анализ молекулярной структуры триозофосфатизомеразы также показал, что он проявляет свойства электростатического акцептора протонов, что обеспечивает более эффективное участие их в обменных реакциях.
Особенность данного фермента заключается в его способности к дифференциальному связыванию субстрата и продукта, что позволяет ему обратить ход реакции в зависимости от концентрации данных молекул в среде.
В целом, механизм катализа триозофосфатизомеразы объясняется моделью электростатического переключателя и может предоставлять много примеров эффективного участия фермента в различных химических реакциях, включая центральные процессы гомеостаза в клеточной среде.
Механизм катализа триозофосфатизомеразы
Механизм катализа этой реакции включает в себя несколько шагов. Во-первых, активный центр фермента, содержащий ионы металлов и кислотные остатки, связывает фермент с субстратом. Далее, фермент-субстрат комплекс подвергается серии конформационных изменений, ведущих к формированию необходимого для реакции активного центра. Затем происходит химическая реакция, в результате которой происходит образование новой ковалентной связи.
Фермент-субстрат комплекс обладает внутримолекулярной связью, которая приближает активные центры фермента и субстрата достаточно близко друг к другу для ионов и ковалентного взаимодействия. Кроме того, активные центры фермента и субстрата сталкиваются, что увеличивает вероятность химической реакции.
Основной механизм катализа триозофосфатизомеразы связан с эффектом индуцированной подгонки и дифференциального связывания, при котором фермент изменяет свою конформацию, чтобы приспособиться к субстрату. Этот механизм обеспечивает более эффективный катализ и более быстрое высвобождение продуктов реакции.
Кроме того, механизмом катализа триозофосфатизомеразы является эффект туннелирования, при котором снижается барьер энергии реакции через ферментный канал. Это позволяет свободным молекулам протонов и других ионов диффузировать через каналы ферментов и участвовать в химической реакции.
Таким образом, механизм катализа триозофосфатизомеразы включает в себя ориентацию субстрата и фермента, подгонку их структуры, образование ковалентной связи и высвобождение продуктов реакции. Эти особенности катализа обеспечивают эффективность и специфичность фермента в выполнении своей функции.
Коферментная реакция
Многие ферменты, таким образом, являются коферментами, то есть они не могут катализировать реакцию в отсутствие специальных молекул – коферментов.
В результате ряда экспериментов, проведенных W. Warshel в 1970 году, и Александром Дыбы в 1979 году была разработана новая концепция, известная как теория «ферментативной дыбы». Эта концепция альтернативного модель лечения, которая предлагает, что реакции внутри биологических систем могут протекать через квантово-силовые эффекты, такие как туннелирование, виртуальные состояния и энтропийное влияние.
Коферментные системы являются резервуарами энергии, включая молекулы NAD +, NADP +, FAD и FMN, и металлы, такие как железо и цинк, которые донорны электроны в окислительно-восстановительные реакции. Коферменты катализируют реакции, перенося электроны от одного вещества к другому, тем самым снижая энергетический барьер и ускоряя реакцию.
Ферменты должны быть специализированными для обработки своих субстратов, поэтому существует большое разнообразие ферментативных реакций, которые происходят в клетке. В случае субстратной протеолиза, протеазы катализируют гидролиз peptide bonds в протеиновых молекулах, превращая их в более мелкие пептиды или аминокислоты.
Коферментные реакции происходят во многих процессах, таких как биосинтез белка, репликация ДНК, клеточное дыхание и многие другие.
Важным элементом коферментных реакций является включение катализаторы, то есть металлы, которые помогают активировать субстраты. Например, многие ферменты содержат аспарагиновую кислоту или сериновую группу, которая принимает протоны от субстрата или участвует в других стадиях реакции.
Коферментные реакции также могут происходить в растворе воды или в водородном окружении, вызывая электронные переносы между субстратами и окислителями. Например, в реакции с кислородом, коферменты могут помочь перенести электроны от субстрата к кислороду, что позволяет клетке получать энергию.
Вместе с тем, реакции туннелирования могут происходить в смеси растворимых в воде реагентов. Это явление появляется благодаря непрерывному проникновению электрона через потенциальный барьер, которое происходит с использованием квантовой модели. Такое туннелирование может быть главным механизмом, который позволяет происходить биологическим реакциям с большей эффективностью.
Роль каталитических остатков

Коферменты — это органические соединения, которые участвуют в ферментативных реакциях как временные переносчики химических групп. Они могут быть привязаны к ферменту или находиться в растворе. Коферменты участвуют в многих реакциях, таких как окислительно-восстановительные реакции и трансфер фосфатных групп.
Каталитические остатки — это аминокислотные остатки в активном центре фермента, которые принимают активное участие в химической реакции. Они выполняют роль активного центра и обеспечивают оптимальные условия для протекания реакции. Ключевыми каталитическими остатками в ферментативной реакции являются гистидин, аспартат и серин. Эти остатки участвуют в различных стадиях ферментативной реакции, обеспечивая связь со субстратом, подгонку субстрата, стабилизацию переходного состояния и активацию субстрата для более эффективного химического превращения.
Особенно важную роль играет протонная передача между каталитическими остатками во время реакции. Протонная передача активирует и деактивирует каталитические центры, осуществляет стадию переноса протона и позволяет реализовать желаемую химическую реакцию. Также важно отметить возможность туннелирования водородных исотопов через активный центр фермента, что может значительно повлиять на реакционную скорость.
Модель взаимодействия фермент-субстрат
Фермент-субстратное взаимодействие включает в себя ряд стадий, включая встречу, связывание и освобождение. Большие исследования на эту тему были проведены в Американском журнале «Modern reviews in solution chemistry». Одной из предложенных моделей описания этого взаимодействия является «молекулярно-динамическая модель», которая предполагает, что фермент и субстрат подгоняются друг к другу, исходя из близости и подгонки их молекулами. Эта модель также объясняет влияние эффектов снижения барьера активации при каталитическом действии каталитических остатков.
В итоге, понимание роли каталитических остатков в ферментативном катализе позволяет расширить наши знания о природе этих процессов и их значении в биологических системах. Коферменты и активные центры ферментов играют решающую роль в химических реакциях, осуществляя эффективное превращение субстратов в продукты.

0 Комментариев