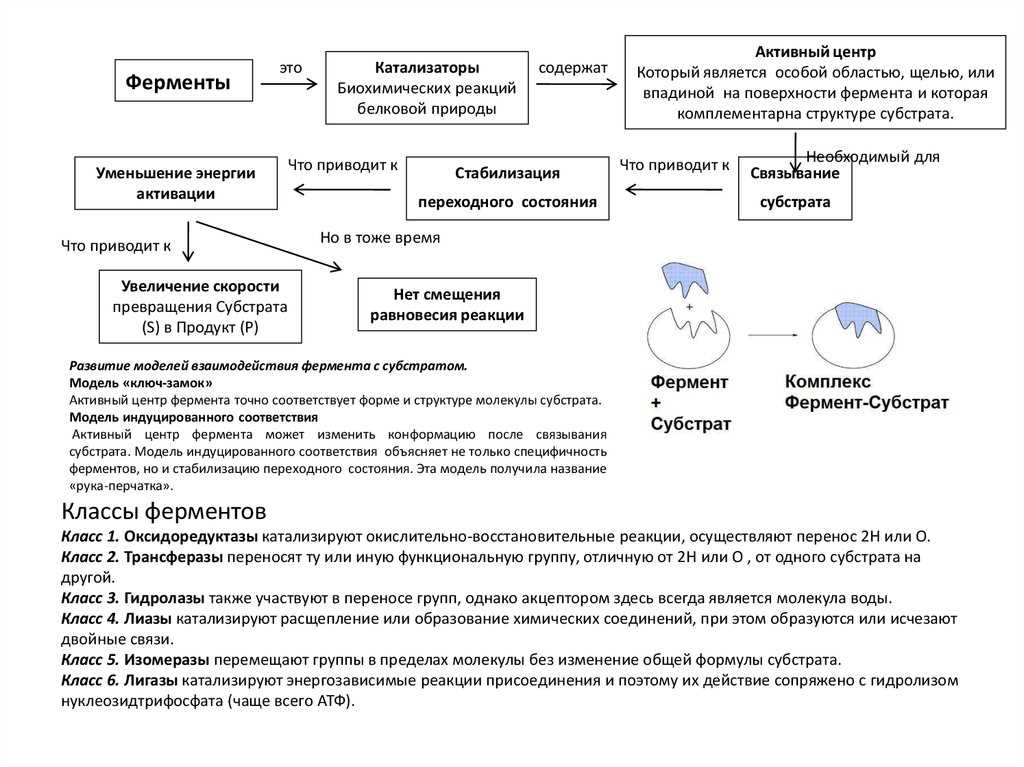
Биохимические реакции являются основой многих жизненно важных процессов, происходящих в клетках организмов. Они обеспечивают превращение одного вещества в другое с участием ферментов – белков, специфическое действие которых обусловлено их структурой и конформационной гибкостью.
В зависимости от числа субстратов, участвующих в реакции, существуют различные типы биохимических реакций. Одним из таких типов являются реакции, в которых участвует только один субстрат. К ним относятся, например, реакции гидролиза, при которых фермент катализирует расщепление молекулы с высвобождением особой большой величины энергии.
В то время как у ферментативного гидролиза коэффициенты молекул довольно малы (около мкмоль), реакции, в которых участвуют два или более субстрата, представляют собой более сложные процессы. В таких реакциях субстраты образуют комплекс с ферментом, что позволяет организовать существенное число взаимодействий между их атомами. Так, ассоциация осцилляционно-мощных мускул (muscle myosin) с активированным актином сопровождается несколькими частями каталитической подединицы ферментативного комплекса, и сопровождается изменением их физических параметров с точностью до измерений, равных коэффициенту избытка 0,09-0,13. При достаточной сходности или специфичности взаимодействия, и в случае отсутствия препятствует нековалентных взаимодействий, характерных для каталитической модификации, существует возможность объяснять многообразие реакций на уровне структуры и последующих физических изменений.
Структурная биохимия — Учебное пособие — Е. А. Бессолицына 2015
В биохимических реакциях число субстратов может быть различным. Существует несколько типов реакций, которые классифицируются по числу субстратов, участвующих в реакции.
Одним из таких типов является реакция с участием двух субстратов. Это обратимые реакции, в которых два субстрата превращаются в два продукта. Например, реакция NADP-зависимой изоксимасловой дигидратазы:
NADP+ + 2-метил-2,4-диоксопентановая кислота ⟶ NADPH + 2-метил-3-оксопентановая кислота
В этом примере участвуют два субстрата: NADP+ и 2-метил-2,4-диоксопентановая кислота. После реакции образуется два продукта: NADPH и 2-метил-3-оксопентановая кислота.
Существуют также реакции, в которых участвуют три субстрата. Одним из примеров таких реакций является реакция аспартатаминотрансферазы:
L-аспарагиновая кислота + L-глутаминовая кислота + a-кетоглутаровая кислота ⟶ аспартат + глутамин + оксалоацетат
В этом примере участвуют три субстрата: L-аспарагиновая кислота, L-глутаминовая кислота и a-кетоглутаровая кислота. После реакции образуется три продукта: аспартат, глутамин и оксалоацетат.
Также существуют реакции с участием большего числа субстратов, например, гидролиз белка. В данном случае каждый аминокислотный остаток белка является отдельным субстратом.
Важное значение в реакциях с участием нескольких субстратов имеет конформационная модификация фермента, которая требуется для связывания всех субстратов одновременно. Такие модули называют каталитическими модулями. Впрочем, существуют и такие реакции, в которых фермент способен связываться с каждым субстратом отдельно (например, конкурентном или последовательном механизмах). Возможна также модификация трехмерной структуры фермента после связывания одного из субстратов, то есть в процессе «ступеньки». В таком случае модуль (или ступенька) отвечает за положение и последовательность связывания.
В реакциях, в которых участвуют несколько субстратов, также может присутствовать и обратимое преобладание одной из формы, каждая из которых связывается с определенным субстратом (или схожными субстратами); либо же присутствует состояние, когда схожие субстраты формируют изоферменты обратимых и одновременных реакций. В таких случаях, если в обратимой реакции присутствует несколько субстратов, энергетически более предпочтительным вариантом является энергетически экономичная реализация прямой реакции.
Таким образом, все биохимические реакции классифицируются по числу субстратов, участвующих в реакции, и варьируются от простых реакций с двумя субстратами до более сложных реакций с участием трех и более субстратов.
Классификация ферментов и их номенклатура
Ферменты играют важную роль в жизни организмов, осуществляя биохимические реакции, необходимые для метаболического обмена. Существует множество классификаций ферментов, однако одна из наиболее распространенных основана на их номенклатуре и связана с числом субстратов, с которыми они взаимодействуют.
В зависимости от числа субстратов, ферменты делятся на несколько типов:
- Моносубстратные ферменты — взаимодействуют только с одним субстратом при проведении реакции. Примером такого фермента является глюкоза-6-фосфатдегидрогеназа, которая участвует в процессе окисления глюкозы-6-фосфата.
- Бисубстратные ферменты — обладают способностью связываться и катализировать реакции с двумя субстратами. Например, ацетил-КоА-карбоксилаза участвует в реакции декарбоксилирования и дегидрирования ацетил-КоА.
- Мультисубстратные ферменты — взаимодействуют с более чем двумя субстратами. Один из примеров такого фермента — холинэстераза, которая связывается с ацетилхолином и молекулой воды, приводя к их взаимопревращению.
Кроме разделения по числу субстратов, ферменты могут классифицироваться и по другим критериям: по типу реакции, которую они катализируют, или взаимодействию с ингибиторами. Например, ингибирование фермента может быть конкурентным, когда ингибитор связывается с активным центром фермента, или неконкурентным, когда он связывается с другой частью фермента.
Номенклатура ферментов представляет собой систему названий, которая позволяет идентифицировать конкретные ферменты. В названии ферментов присутствуют информация о типе реакции, участвующих реагентов и других характеристиках. Например, ферменты, связанные с окислительными реакциями, могут иметь в названиях термины «оксидаза» или «дегидрогеназа».
Номенклатура ферментов имеет учебное значение и позволяет обеспечить достаточное понимание идентификации и классификации ферментов в биохимических реакциях. Кроме того, она справедливо считается одним из главных барьеров перед разработкой активных ферментных препаратов для эффективной энзимотерапии.
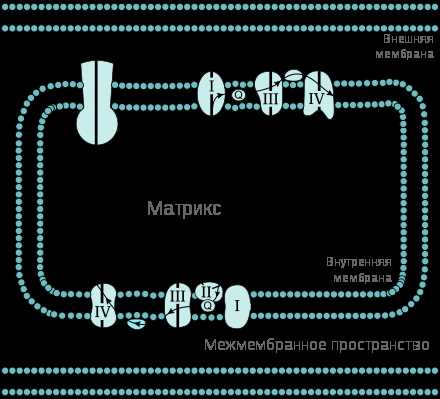
Локализация ферментов в клетке
Ферменты играют важную роль в медицинской биохимии человека. Они катализируют реакции, необходимые для обеспечения жизнедеятельности клеток и тканей. Локализация ферментов в клетке имеет большое значение, поскольку она определяет их функцию и регуляцию активности.
Клетку можно представить как город, где различные ферменты выполняют специфические задачи. Эта группа ферментов, называемых тканеспецифическими или компартментными ферментами, сосредоточена в определенных частях клетки — компартментов.
В современной медицинской биохимии известно множество типов компартментации ферментов — от простого расположения в цитоплазме до присоединения к мембранам различных органелл клетки.
Расположение ферментов в клетке зависит от их функции. Например, в плазме клеток сердца ферменты, катализирующие реакции субстратов, соответствуют основным процессам обеспечения энергией, а также регуляции и длительного изменения концентрации ионов и метаболитов в клетке.
Компартментация ферментов обеспечивает непосредственное участие в регуляции активности реакции. Например, изменение концентрации кислорода или фосфата в окружающей среде фермента может привести к изменению конформации фермента и, как следствие, к изменению его катализаторной активности.
Также известно много примеров, когда изменение локализации фермента в клетке приводит к изменению его функции или регуляции. Например, в некоторых болезненных состояниях изменение локализации фермента может привести к его активному сокращению или наоборот, к его отсутствию в определенных компартментах клетки.
Важным механизмом распределения ферментов в клетках является их специфичность к субстрату или изменению концентрации определенных метаболитов. Например, ферменты, способные катализировать реакции с аминокислотами, могут быть локализованы в местах активного синтеза белков — рибосомах.
Таким образом, локализация ферментов в клетке играет важную роль в регуляции и функционировании клеточных процессов. Она определяет эффективность катализирующего действия фермента, его специфичность и регуляцию активности. Изучение локализации ферментов в клетке имеет большое значение для понимания биохимических процессов в организме человека и разработки новых методов диагностики и лечения различных заболеваний.
МОДУЛЬ 2 ЭНЗИМОЛОГИЯ
Аллостерический эффект играет важную роль в регуляции ферментативной активности. Взаимодействие фермента с ингибитором или активатором приводит к изменению его активности. Эти взаимодействия могут происходить на уровне аминокислотных остатков фермента или на уровне связывания кофакторов.
Регуляторные молекулы могут изменять конформацию фермента, что приводит к изменению его каталитического активного центра. В результате этого фермент может стать либо менее активным, либо наоборот, его активность может увеличиться.
Теория конкурентного и неконкурентного ингибирования
Для объяснения взаимодействий фермента с ингибиторами используется теория ингибирования, в которой рассматриваются два типа ингибирования: конкурентное и неконкурентное.
Конкурентное ингибирование происходит, когда ингибитор конкурирует с субстратом на связывание с активным центром фермента. В этом случае ингибитор и субстрат не могут одновременно находиться в активном центре фермента.
В неконкурентном ингибировании, ингибитор связывается с ферментом вне активного центра, образуя комплекс с ферментом-субстратом. В этом случае ингибитор может связываться с активным центром в присутствии субстрата.
Результаты взаимодействий
В результате взаимодействия ингибиторов и активаторов с ферментами, их активность может снижаться или повышаться. Однако, необходимо отметить, что взаимодействия между ферментом и ингибитором могут быть прочными или слабыми.
Прочные взаимодействия обычно происходят при высоких концентрациях ингибиторов и могут приводить к полному или почти полному подавлению активности фермента. Слабые взаимодействия, напротив, происходят при низких концентрациях ингибиторов и могут вызывать частичное подавление активности фермента.
Классификация по числу субстратов
Биохимические реакции классифицируются по числу субстратов, участвующих в катализе ферментами. В случае с односубстратными реакциями фермент связывается только с одним субстратом и катализирует его превращение в продукты.
Двусубстратные реакции предусматривают взаимодействие фермента с двумя субстратами. В этой ситуации фермент может катализировать образование продукта из обоих субстратов, либо превращение одного субстрата в другой.
Многосубстратные реакции включают в себя взаимодействия фермента с тремя и более субстратами. В этом случае фермент может катализировать образование продуктов из всех субстратов либо образование продуктов из некоторых субстратов.
Примеры реакций
Примерами односубстратных реакций являются реакции, в которых фермент катализирует превращение одного субстрата в продукт. Например, фермент гексокиназа катализирует превращение глюкозы в глюкозу-6-фосфат при участии каталитического центра фермента.
Примеры двусубстратных реакций включают реакции, в которых фермент взаимодействует с двумя субстратами и превращает их в продукты. Например, фермент фумаратгидратаза катализирует превращение фумарата и воды в малат.
Многосубстратные реакции представляют собой более сложные процессы, в которых фермент взаимодействует с тремя или более субстратами. Примером такой реакции является реакция, в которой фермент глицеринкиназа катализирует образование NADH и амидов с помощью трех субстратов: глицерина, АТФ и NAD+.
В энзимологии также применяется классификация реакций по возможности взаимодействия субстратов и фермента. В этом случае реакции делятся на каталитические, в которых фермент способен взаимодействовать с субстратами и катализировать их превращение в продукты, и некаталические, в которых фермент не способен катализировать образование продуктов.
Номенклатура и классификация ферментов

Ферменты-изомеразы
Ферменты-изомеразы являются одним типом ферментов, которые катализируют реакции изомеризации, то есть превращение одного изомера в другой. Например, апофермент пируваткиназы способен действовать в обеих направлениях: окисление пирувата до ацетилхолина и обратное превращение ацетилхолина в пируват.
Этот тип ферментов обладает активной центральной областью, которая содержит аминокислотные остатки, действующие как катализаторы реакции изомеризации. Изомеразы обычно специфичны к определенным соединениям и поддерживают определенные условия, необходимые для их действия.
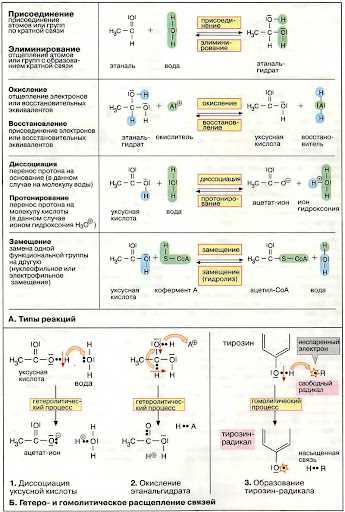
Ферменты с окислительно-восстановительной активностью
Ферменты с окислительно-восстановительной активностью играют важную роль в реакциях окисления и восстановления в живых организмах. Они участвуют в передаче электронов от одного молекулярного партнера к другому, восстанавливая и окисляя различные соединения.
Примером ферментов с окислительно-восстановительной активностью является NADP-зависимый дегидрогеназа. Она обладает высокой специфичностью к NADP и играет важную роль в биохимических процессах, таких как фотосинтез.
Фермент-субстратный путь
Фермент-субстратный путь основан на взаимодействии фермента с его субстратом. Этот путь позволяет оценивать сродства между ферментом и его субстратом, а также определенные особенности действия фермента. Например, модификации апофермента могут влиять на активность фермента и его способность связываться с субстратом.
Фермент-субстратный путь также может служить для оценки локализации фермента в организме и его участия в конкретных биохимических путях. Например, электрофореграммы ферментов могут показать различные пути их активности в клетке.
Другие особенности классификации
Классификация ферментов также может быть основана на других особенностях, таких как облегчающие модификации апофермента, специфичность действия фермента, локализация в организме и другие. Все эти особенности могут быть учтены при классификации ферментов и их описании.

0 Комментариев