Ферменты играют важную роль в организмах всех живых существ, ускоряя биохимические реакции и обеспечивая нормальное функционирование клеток. Ферменты являются белками, способными катализировать химические реакции, происходящие в организме.
Механизм работы ферментов основан на их способности связываться с субстратом — молекулой, на которую фермент действует. Фермент присоединяется к субстрату в специфическом месте, называемом активным центром. В результате такого связывания происходит образование комплекса фермента и субстрата, что позволяет провести каталитическую модификацию субстрата.
Функция фермента заключается в том, чтобы ускорить скорость реакции, снизив энергию активации — минимальную энергию, которую необходимо преодолеть для начала реакции. Ферменты достигают этого путем ориентации субстратных молекул в активном центре и формирования временных ковалентных связей между ферментом и субстратом. Благодаря этому, энергия активации снижается и реакция происходит быстрее.
Организмы производят различные ферменты для выполнения различных функций. Например, в желудке присутствуют протеазы — ферменты, специализирующиеся на разрушении пептидных связей в белках, а в слизистых оболочках кишечника находятся амилазы — ферменты, ускоряющие гидролиз крахмала и других углеводов.
Ингибирование ферментов — процесс, при котором фермент становится ингибитором субстрата или другого фермента. Это может происходить путем связывания ингибитора с активным центром фермента или модификации фермента таким образом, чтобы он не мог принять субстрат. Ингибиторы ферментов играют важную роль в регуляции ферментативных реакций в организмах. Их наличие позволяет контролировать скорость и направление реакций, поддерживать биохимическую равновесие и предотвращать избыточные или нежелательные реакции.
В литературе существует множество исследований, посвященных механизму действия ферментов, и их значение для жизни организмов. Благодаря развитию современных технологий, удалось изучить множество ферментов и обнаружить новые. Это позволяет не только лучше понять процессы, происходящие в организме, но и использовать ферменты в промышленном производстве, создавая новые методы производства пищевых продуктов, пива, спирта и других веществ на основе биохимических реакций, катализируемых ферментами.
Как ферменты ускоряют биохимические реакции:

Основным принципом действия ферментов является специфическое связывание субстрата. Фермент связывается с молекулами субстрата, образуя так называемый ферментативный комплекс. Это подобно ситуации, когда ключ (фермент) вставляется в замок (субстрат) и активизирует его для реакции.
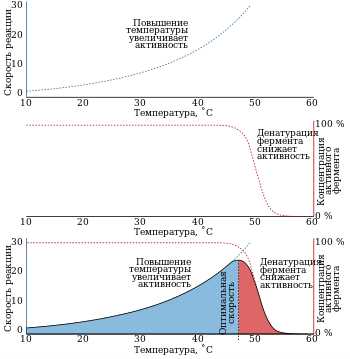
Большинство ферментов имеют активный центр, где происходит промежуточное связывание с субстратом и расщепление его. Ферменты могут быть модифицированы путем влияния различных факторов, включая температуру, pH, наличие кофакторов и ингибиторов.
Действие фермента может быть лишь белковой модификацией, в результате которой меняется форма активного центра и происходит активирование субстрата. Такое влияние часто происходит в результате кофакторов, таких как железо или другие ионные металлы.
В некоторых случаях ферменты образуют комплекс с субстратом, подобно «рука-перчатка», что способствует более тесному взаимодействию и ускоряет реакцию. Например, гликогена субстраты активируют фермент амилазу, улучшая процесс расщепления гликогена.
Применение ферментов:
Ферменты нашли широкое применение в промышленном и химическом производстве. Они используются в основных индустриальных процессах, таких как производство пищевых продуктов, бумаги и текстиля.
Медицинское применение ферментов также очень широко. Исследования показывают, что ферменты могут быть ключевыми активными компонентами в лечении различных заболеваний. Например, протеазы могут быть использованы для моделирования пептидную связь в молекулах, что способствует разработке новых лекарственных препаратов.
Виды ферментативных реакций:
Существует много разных видов ферментативных реакций. Некоторые ферменты могут просто ускорять реакцию, а другие могут изменять тип субстрата или быть ингибитором фермента. К таким видам реакций относятся ковалентные модификации, активация или ингибирование ферментов и многие другие.
Исследования в области ферментов важны для понимания их действия и разработки новых методов лечения и производства. Использование ферментов имеет широкий потенциал в медицине, промышленности и других областях науки.
| Тип ферментативной реакции | Примеры |
|---|---|
| Активация фермента | Амилаза усваивает гликоген |
| Ингибирование фермента | Ингибиторы протеаз могут замедлять реакцию |
| Ковалентная модификация фермента | Модификация пептидной связи в молекулах |
Принципы действия ферментов
Процесс активации ферментов начинается с их синтеза в клетке, а затем они проходят ряд изменений в своей структуре. Ферменты могут иметь простую структуру, состоящую только из белковой цепи, или быть сложными соединениями с множественными подединицами. Такие ферменты имеют четвертичную структуру, что обеспечивает им более высокую активность.
Известно много различных типов ферментов, каждый из которых специфичен к определенному субстрату. Например, амилазы катализируют гидролиз крахмала или гликогена, а панкреатин воздействует на жиры и белки. Ферменты образуют связи с субстратами, образуя ферментативные комплексы, которые активируются через специфическую структуру реагентов и их функциональной группы.
Процесс работы ферментов осуществляется за счет возникновения в центре активности специфической последовательности физических и химических изменений. Одной из основных функций ферментов является регуляция скорости реакции, при которой они увеличивают концентрацию молекул, взаимодействующих с другими веществами.
Скорость кинетической реакции, поддерживаемая ферментами, гораздо выше, чем при отсутствии ферментов. Это позволяет ферментам расщеплять субстраты, например, для извлечения энергии или для производства метаболитов.
Ферменты часто используют как препараты в медицине, промышленности и сельском хозяйстве. Например, ферменты часто применяются в производстве пищевых продуктов для улучшения их качества и увеличения срока годности.
Однако за счет ингибиторов, таких как ионы железа или специальные препараты, ферменты могут быть неактивны и перестать катализировать реакции. Удаление таких ингибиторов или изменение их концентрации может привести к активации ферментов.
История изучения ферментов началась с Литературы начала 20 века. С того времени было проведено множество исследований, которые объясняют механизм действия ферментов, их структуру, а также регуляцию процессов, которые ими катализируются.
Всего известно более 4000 различных ферментов, каждый из которых выполняет свою функцию в клетке. Ферменты могут быть кофакторами, необходимыми для выполнения реакции, или участвовать в регуляции и контроле. Они играют важную роль в клеточных процессах и обеспечивают точную и эффективную работу организма.
В общем, принципы действия ферментов основываются на их способности связываться с субстратом и активировать его для проведения химической реакции. Биохимические реакции, катализируемые ферментами, происходят в определенной среде, обеспечивая эффективность реакции.
Примечания: ферменты также называют энзимы, центром активности фермента является его активный центр, активность ферментов может быть контролируется факторами среды, такими как pH и температура.
Роль кофакторов в действии ферментов
Кофакторы существуют в двух формах: органические и неорганические. Органические кофакторы называют коэнзимами и могут быть сложными органическими молекулами, такими как витамины или нуклеотиды, или простыми неорганическими ионами. Неорганические кофакторы называют катализаторами и могут быть металлами, например, железом или цинком.
Кофакторы играют важную роль в действии ферментов. Они помогают установить нужную структуру фермента, взаимодействуя с определенными аминокислотами и оказывают влияние на его трехмерную структуру. Благодаря этим изменениям ферменты приобретают специфичность к субстрату и могут эффективно превращать его в продукт реакции.
Существует несколько теорий о механизме действия кофакторов на ферменты. Одна из них предполагает, что кофактор лишь один раз участвует в реакции, образуя промежуточный комплекс с ферментом и субстратом, после чего участвовать в реакции больше не может. Другая теория утверждает, что кофактор может образовывать необратимые связи с аминокислотными остатками фермента, участвуя в катализирующей функции.
Ферменты, зависимые от кофакторов, классифицируют на несколько видов в зависимости от химической природы кофактора. Например, ферменты, использующие в качестве кофакторов металлы, такие как цинк или магний, называются металлопротеазами. Примером такого фермента является реннин — фермент, синтезирующийся в пищеварительных железах и необходимый для гидролиза белка в молоке.
Изучения роли кофакторов в действии ферментов ведутся уже много лет. Это направление находится в центре внимания многих исследователей не только в биохимической, но и в медицинской литературе. Использование ферментов и их кофакторов находит широкое применение в различных областях, включая производство пищеварительных ферментов, синтез аминокислот, производство лекарственных препаратов и прочее.
Важность ферментов в жизни организмов
Существует множество различных ферментов, которые выполняют свои функции в разных организмах. Например, амилаза – фермент, который участвует в расщеплении полисахаридов в простые сахара. Он присутствует в слюне и желудочном соке человека и многих других животных. Это позволяет организмам расщеплять пищу и усваивать необходимые питательные вещества.
Одной из важнейших особенностей ферментов является их способность быть активными только в определенных условиях. Некоторые ферменты активируются или ингибируются в зависимости от физиологических параметров организма, таких как температура или pH. Это позволяет контролировать реакции и приспосабливаться к изменениям внешней среды.
Ферменты также играют важную роль в промышленных процессах, таких как производство спирта и брожение. В процессе брожения ферменты активируются и образуют алкогольные продукты из углеводов. Это явление было впервые описано Луи Пастерном в 1857 году и послужило основой для развития теории ферментов.
Ферменты не только ускоряют реакции, но и обеспечивают их специфичность. Каждый фермент взаимодействует только с определенным субстратом, формируя фермент-субстратный комплекс. Это связывание происходит благодаря особым участкам фермента, называемым активными центрами. Активный центр обладает определенной структурой и химической природой, что позволяет ему подобно ключу открыть замок субстрата и превратить его в продукт реакции.
Важным аспектом ферментов является их способность к реакции между субстратом и аминокислотными остатками. Это приводит к образованию ковалентной связи между ферментом и субстратом, что усиливает их взаимодействие и активность.
Ферменты играют важную роль в многих биохимических процессах, наряду с другими молекулами и структурами, такими как гены и белки. Они являются неотъемлемой частью жизни организмов и имеют большое значение для их нормального функционирования.
| Примеры ферментов: | Место действия: |
|---|---|
| Амилаза | Слюна, желудок |
| Химотрипсиноген | Желудок |
| Микразим | Поджелудочная железа |
Как ферменты связываются с субстратами
- Синтезируется большое количество ферментов, и каждый из них имеет свой уникальный активный центр.
- На протяжении многих лет проводятся исследования, направленные на изучение структурных и функциональных свойств ферментов.
- Центральная роль при каталитических реакциях принадлежит каталитическому центру фермента.
- В 1897 году французский ученый Эмиль Фишер предложил модель ключ-замок для объяснения специфичности ферментов в связи с соответствующим субстратом.
- Ферменты имеют высокую активность по счету химической природы ионов, которые активируют центр фермента.
- Амилаза, каталитический центр которой содержит ионы магния или кальция, способна катализировать гидролиз крахмала и гликогена.
- Использование ферментов в медицине стало возможным благодаря исследованиям структурных и функциональных свойств ферментов и их активным центрам.
- Одна из важных реакций, катализируемой ферментами, это химическая реакция фосфорной кислоты.
- Амилазы желудка и поджелудочной железы катализируют гидролиз крахмала и глицерида, используя в качестве активного центра каталитический центр фермента.
- Ферменты могут связываться с субстратами через большую часть их белковых групп и ионами металлов.
- Существует классификация ферментов по типу их активности и структурным свойствам.
- Ферменты могут быть активными по отношению к одним реакциям, но практически бездействовать по отношению к другим.
- Ферменты могут индуцировать активный центр при связывании с определенными ионами, амино- и карбоксильными группами субстрата.
- Вследствие специфичности активного центра фермента, он может связываться только с определенным типом субстрата.
- Ферменты выполняют важную роль в метаболических процессах организма и могут быть использованы в терапии различных заболеваний.
Теория активных центров ферментов
Активный центр фермента представляет собой сложную структуру, которая обладает свойствами «ключ-замок». Это значит, что определенная молекула фермента может активироваться лишь под воздействием определенного субстрата. Таким образом, активный центр определяет, какая реакция будет происходить. Кинетические и брокгауза препаратом механизмы практически изучены на примере наиболее сложных ферментативных реакций, таких, как синтезируется ферментом креатиназа, амилазы и микразим.
Ферменты могут также ингибировать другие ферменты, что называется ингибированием. Ингибирование может быть ковалентным (прикреплением к ферменту другого атому или группы аминокислот) или неисложным (блокировкой активного центра фермента другими молекулами, такими как анионы или ионы кислого металла).
Исследования ферментов позволили практически использовать их свойства. Многие ферменты, такие как амилазы и микразим, используются в пищеварительных препаратах для повышения активности пищеварения в желудке и кишечнике. Другие ферменты могут быть использованы для синтеза сложных органических соединений в промышленности или для модификации других ферментативных реакций.
Регуляция активности ферментов
Ферменты играют важную роль в биохимических реакциях, ускоряя их процессы и необходимые для жизнедеятельности организмах. Однако активность ферментов должна быть строго регулируемой, поскольку не контролируемое количество ферментов может нанести вред клеткам и органам, а также повлиять на процессы, в которых они участвуют.
В клетках существуют различные механизмы регуляции активности ферментов. Один из них — ингибирование. Ингибиторы – это молекулы, которые связываются с ферментом и препятствуют его активности. Это может происходить путем конкуренции с субстратами или изменения структуры фермента. Например, панкреатин – это препарат, содержащий тройной энзимный комплекс амилаз, липаз и протеаз, который используется при расстройствах пищеварения. Препарат «Микразим» содержит панкреатин и используется для стимуляции и улучшения пищеварения. Этот препарат обладает способностью ингибировать некоторые ферменты в желудочно-кишечном тракте, тем самым регулируя пищеварительные процессы в организме.
Еще один механизм регуляции активности ферментов – активация. Активаторы – это молекулы, которые способны повысить активность фермента, обычно путем изменения его конформации. Например, реннин – фермент, который синтезируется в желудке млекопитающих и участвует в гидролизе (расщеплении) молекулы белка казеина в процессе созревания и обработки молока. Реннин может быть активирован под действием различных аминокислот и ионов, обеспечивая эффективность реакции гидролиза белка.
Также, активность ферментов может быть регулируемой через фосфорную группу, присоединяемую к аминокислотам в центре активности фермента. Фосфорилирование – это процесс присоединения фосфорной группы к аминокислоте, обусловленный действием специфических киназ и фосфатаз. Передача фосфорной группы изменяет конформацию фермента, что приводит к активации или ингибированию его функции.
Ингибирование ферментов
Ингибирование ферментов – процесс, при котором ингибитор связывается с ферментом и препятствует его активности. Ингибиторы могут быть конкурентными или неконкурентными.
Конкурентные ингибиторы конкурируют с субстратом за связь с активным центром фермента. Они обычно также подобным образом связываются с активным центром, что и субстрат, и в результате эффективность ферментной реакции снижается. Примером конкурентного ингибитора является препарат тиреостатик, который препятствует синтезу гормонов щитовидной железы путем конкуренции с одной из необходимых реакций для синтеза щитовидных гормонов.
Неконкурентные ингибиторы не конкурируют с субстратом за связь с активным центром ферментного белка. Они связываются с ферментом на других линиях, при этом они изменяют конформацию ферментного белка, что препятствует его активности. Примером неконкурентного ингибитора является альфа-аманитин — ядовитое вещество, которое структурно подобно нуклеосиду и связывается со вторичной структурой РНК-полимеразы, ингибируя ее функцию.
Активация ферментов
Активация ферментов – процесс, при котором активатор связывается с ферментом и усиливает его активность. Активаторы могут быть конформационными или аллостерическими.
Конформационные активаторы изменяют конформацию ферментного белка, что увеличивает его активность. Примером конформационного активатора являются ион Ca2+, который активирует многие ферменты, отвечающие за сократительную функцию мышц.
Аллостерические активаторы связываются с ферментом не на активном центре, а на аллостерическом сайте, что изменяет конформацию ферментного белка и усиливает его активность. Примером аллостерического активатора является амплификационный эффект глюкозы на активность гексокиназы в гликолизе. Амплификация – это процесс усиления сигнала или активности.
Таким образом, регуляция активности ферментов является важным механизмом поддержания биохимических процессов в клетке. Поскольку ферменты катализируют сложные метаболические реакции, их активность должна быть тщательно регулируема, чтобы обеспечить эффективность и стабильность жизнедеятельности клетки и организма в целом.
Примечания:
- Весь период работы с ферментами и препаратами, связанными с ними, должен проводиться с соблюдением правил безопасности и в лаборатории, оборудованной специальными средствами защиты, такими как рука-перчатка, маска и другие.
- Данная статья является обзором и научным материалом для более подробного изучения рекомендуется обращаться к специализированной литературе и словарям биохимии.
Практическое значение ферментов
В промышленности ферменты используются для синтеза различных продуктов, таких как пищевые добавки и лекарства. Например, ферменты типа липазы и амилазы применяются в производстве пива, чтобы ускорить процесс сахаристой ферментации и обеспечить правильные органолептические свойства пива. Также фермент реннин используется при производстве сыра для свертывания молока и образования сгустка.
В пищеварительной системе ферменты играют ключевую роль в разложении пищи. Они присутствуют в слизистых клетках и железах органов пищеварения и помогают разлагать пищевые вещества на более простые формы, которые могут быть усвоены организмом. Например, амилазы расщепляют полисахариды на моносахариды, а протеазы разлагают белки на аминокислоты.
Кроме того, ферменты имеют большое значение в медицине. Они могут использоваться в качестве диагностических маркеров для определения наличия или отсутствия определенных заболеваний. Например, повышенное содержание определенных ферментов в крови может указывать на повреждение клеток печени или мышц. Ферменты также могут быть использованы как ингибиторы в биохимических реакциях, чтобы замедлить или приостановить протекание реакции.
Таким образом, ферменты имеют большое значение во многих областях жизни. Изучение и понимание принципов их действия позволяет использовать их для ускорения химических реакций, а также в диагностике и лечении различных заболеваний. Поэтому важно развивать и совершенствовать методы исследования ферментов и их модификации с целью повышения их функциональной активности и создания новых ферментов с желаемыми свойствами.
Перспективы использования ферментов в промышленности
Ферменты, благодаря своим уникальным биохимическим свойствам, нашли широкое применение в различных отраслях промышленности. Их использование позволяет значительно ускорить химические реакции и повысить эффективность производственных процессов.
Одним из ключевых аспектов, способствующих применению ферментов, является их энциклопедический характер. Большинство ферментов способно катализировать широкий спектр реакций, что позволяет использовать их для различных целей.
Ферменты обладают определенными структурными особенностями, позволяющими им выполнять свои функции. Активный центр фермента является основным местом, где происходит взаимодействие субстрата и образование продукта реакции. Например, в ферменте панкреатин центром активности является группа сульфгидриловых (-SH) белковых остатков, связывающих субстрат и активирующих гидролиза.
Ферменты могут быть использованы для гидролиза различных органических соединений. Например, они могут ускорить брожение, в результате которого алкогольные напитки получаются гораздо быстрее. Также ферменты применяются в производстве пищевых продуктов, фармацевтических препаратов, моющих средств и многих других товаров.
Применение ферментов в промышленности имеет ряд преимуществ. Они обладают высокой катализирующей активностью и могут работать при низких температурах, что позволяет сократить энергозатраты на производство. Кроме того, использование ферментов позволяет получить более чистые продукты, так как они конкретно взаимодействуют только с определенными субстратами.
- Ферменты могут быть получены из различных источников, включая растения, животные и микроорганизмы. Например, панкреатин можно извлечь из поджелудочной железы животных, а рибонуклеазу можно получить из клеток грибов.
- Ферменты могут применяться в различных формах, включая жидкие, порошковые и гранулированные. Это позволяет выбрать наиболее удобную форму в зависимости от целевого процесса.
- Ферменты могут быть модифицированы для улучшения их свойств. Например, изменение структуры активного центра может повысить активность фермента или изменить его специфичность.
Одним из главных направлений применения ферментов в промышленности является производство биологически активных веществ, таких как фармацевтические препараты и биологически активные добавки. Ферменты могут использоваться для синтеза сложных органических молекул, таких как аминокислоты, нуклеотиды и полисахариды.
Перспективы использования ферментов в промышленности огромны. Они помогают ускорить процессы производства, снизить затраты на энергию и создать более чистые и качественные продукты. Благодаря своим уникальным свойствам и широкому спектру действия, ферменты стали незаменимыми инструментами в промышленности и продолжают привлекать внимание исследователей и специалистов в этой области.

0 Комментариев