
Биологические катализаторы играют важную роль в живых организмах, повышая скорость биохимических реакций. Одним из основных элементов, обладающих свойствами катализаторов, являются ферменты — сложные белковые соединения. Ферменты образуются из аминокислотных остатков и состоят из полипептидной цепи. Каждый фермент состоит из одной или нескольких субъединиц, молекулярная масса которых варьирует от нескольких десятков тысяч до нескольких миллионов Дальтон.
Ферменты обладают сложной структурой, включающей вторичную и третичную структуру. Вторичная структура представляет собой складчатый участок полипептидной цепи, в котором образуются основные элементы — α-спираль и β-структуры. Третичная структура включает в себя пространственное расположение вторичных структур и образует активный сайт, в котором осуществляется связь фермента с другими молекулами.
Возникающая в результате сложения аминокислотных остатков фермента структура, их свободная подвижность и специфичность атомов обеспечивают определенные химические реакции. Таким образом, ферменты могут быть определены как катализаторы, то есть вещества, ускоряющие химические реакции без изменения своей структуры.
Сравнение химического и ферментативного катализа
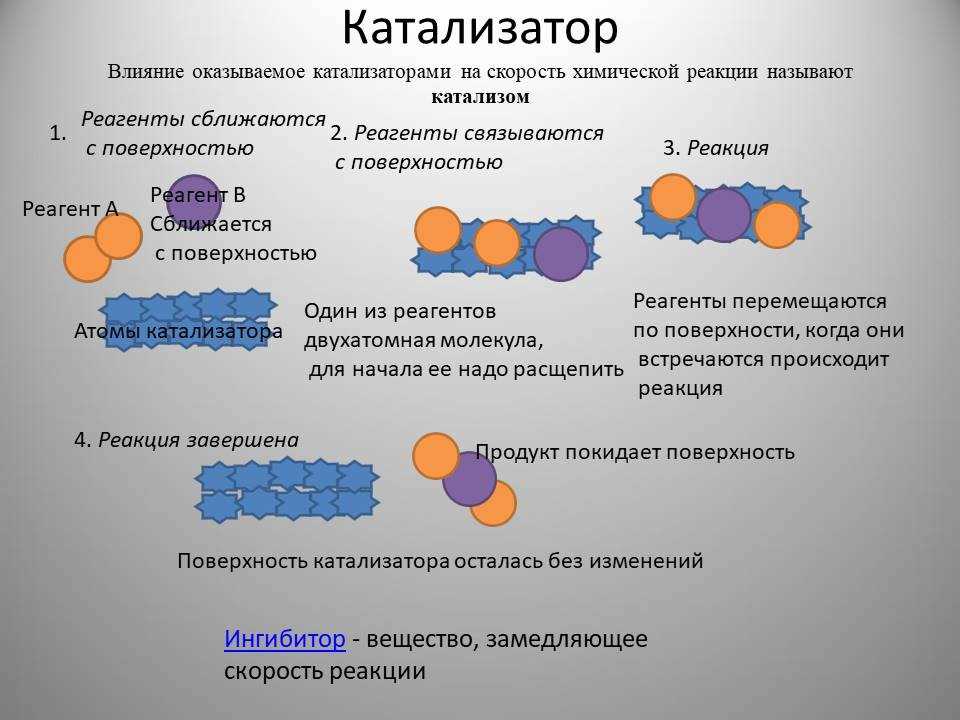
Ферментативный катализ – это процесс, который осуществляется ферментами, специальными белками, которые участвуют в реакциях, происходящих в организме. Одним из ключевых отличий между химическим и ферментативным катализом является специфичность ферментов к определенным реакциям и субстратам. Ферменты могут различать различные химические группы, которых химические катализаторы не могут, благодаря своей уникальной структуре.
Белки ферментов состоят из аминокислотных остатков, участков которых могут образовывать различные структуры, такие как α-спираль или β-структуры. Также, ферменты могут иметь четвертичную структуру, представляющую собой соединение из двух или более субъединиц. Субстрат взаимодействует с активным участком фермента, который образован гидрофобными группами аминокислот и рядом смежных атомов.
Одна из основных ролей ферментативного катализатора – это снижение энергии активации реакции. Это достигается благодаря специфичной структуре фермента, которая создает определенную окружающую среду, в которой реакция может протекать более эффективно. Также ферменты способны к координации ионов металла, которые играют важную роль в некоторых реакциях. Белки ферментов также могут изменять конформацию для более точного взаимодействия с субстратом.
В результате своей структуры и специфичности белков, ферменты обладают большей эффективностью и селективностью в катализе реакций, чем химические катализаторы. Ферментативные катализаторы могут осуществлять тысячи или даже миллионы реакций в секунду, в то время как химические катализаторы обычно более медленны в своих реакциях.
Таким образом, химический и ферментативный катализ имеют свои уникальные особенности и преимущества. В то время как химический катализатор активирует реакцию за счет свободной энергии молекул, ферментативный катализатор осуществляет реакцию благодаря специфической структуре белков и координации ионов металла. Вместе они играют важную роль в повышении скорости биохимических реакций в живых системах.
Строение белковой молекулы
Белковая молекула состоит из аминокислотных остатков, которые образуются в результате реакции между аминогруппой одной аминокислоты и карбоксильной группой другой. Эти остатки связываются между собой пептидными связями, образуя цепь.
Структура белков может быть различной и представляет собой последовательность трех уровней: первичную, вторичную и третичную структуры.
Первичная структура
Первичная структура белка определяется последовательностью аминокислотных остатков в полипептидной цепи. Она является абсолютной и составляет главную химическую информацию белка. Первичная структура определяет последующие уровни организации и физиологических свойств молекулы.
Вторичная структура
Вторичная структура белков представляет собой укладку полипептидной цепи в пространстве без образования аминокислотных изогнутостей (изотопов). Вторичная структура может быть в виде спиральной α-правой или α-левой спирали, β-складчатого листа или их сочетания. Её образование происходит в результате взаимодействия атомов водорода групп аминокислот.
Вторичную структуру белка можно различать сравнительным анализом последовательностей остатков аминокислот.
Третичная структура
Третичная структура белков образована взаимодействием боковых цепей остатков аминокислот и представляет собой сложное пространственное строение молекулы. В третичной структуре каждая аминокислотная остаток занимает свою определённую позицию, что определяет специфичность ферментативного катализатора.
Ферменты – это биологические катализаторы биохимических реакций. Они обладают специфичностью, то есть могут различать похожие реагенты и катализировать только одну реакцию из множества возникающих. Такая специфичность объясняется молекулярной структурой фермента и его специфическими группами аминокислотных остатков, которые образуют активный центр фермента. Специфичность фермента также связана с его третичной структурой, которая представляет собой сложный переплет цепи и изгибов.
Ферменты – катализаторы биохимических реакций
Ферменты состоят из белковой части, которая представляет собой цепь аминокислотных остатков, и некоторых небелковых компонентов, таких как кофакторы и каталитические группы. Белковая часть ферментативного фрагмента фермента обладает свободной энергией, которой регулируется активность фермента.
Ферменты взаимодействуют с молекулами субстрата путем образования слабых водородных связей, и других химических взаимодействий, таких как гидрофобные и гидрофильные взаимодействия. Также ферменты обладают специфичностью, то есть могут различать различные типы субстратов и катализировать только определенные реакции. Это обусловлено строением и активным центром фермента, который состоит из определенных аминокислотных остатков, образующих геометрические изгибы или β-структуры, находящиеся рядом с другими атомами. Элементы группы аминокислотных остатков фермента образуют вторичную и даже молекулярную структуру.
Специфичность фермента также может быть обусловлена образованием комплекса фермент-субстрат. В таком комплексе происходит расщепление связи между ферментом и субстратом, и в результате образуется новое соединение. Ферменты также могут обладать вторичной активностью, то есть могут катализировать не только одну реакцию, но и другие реакции, которые подходят по своим характеристикам к активному центру фермента.
| Группа ферментов | Примеры | Функция |
|---|---|---|
| Оксидоредуктазы | Глюкозаоксидаза | Катализируют окислительно-восстановительные реакции |
| Гидролазы | Уреаза | Расщепляют химические связи с помощью воды |
| Лиазы | Аспарагиназа | Катализируют разложение химических связей |
| Трансферазы | Гликогенсинтаза | Переносят группы атомов или молекулы между молекулами субстрата |
| Гидролазы | Амилазы | Расщепляют химические связи с помощью воды |
Эффективность использования ферментов
Ферменты, также известные как биологические катализаторы, играют важную роль в повышении скорости биохимических реакций. Они способны эффективно использовать энергию, которая образуется во время взаимодействия субстрата и фермента.
Структура ферментов состоит из полипептидной цепи, находящейся в активном центре. В этом активном центре могут различаться две структуры — первичная и вторичная. Вторичная структура ферментов образована элементами различного вида изотопов и изгибов аминокислотных групп. Также во вторичной структуре могут быть образованы β-структуры, которые являются основой для образования третичной структуры фермента. Пятая часть всех β-структур является аморфными.
Главная особенность ферментов — возможность образования слабых химических взаимодействий с субстратами. Образование этих химических взаимодействий превышает свободную энергию образования одного элементарного взаимодействия в аминокислотной группе фермента. Количество слабых химических взаимодействий, которые могут быть образованы между субстратом и ферментом, значительно превышает количество свободной энергии, образованной при этих взаимодействиях.
| Тип структуры | Описание |
|---|---|
| Первичная структура | Последовательность аминокислот в полипептидной цепи |
| Вторичная структура | Формирование β-структур и элементов изгибов |
| Третичная структура | Образование пространственной конформации фермента |
| Четвертичная структура | Взаимодействие нескольких полипептидных цепей |
Молекулярная структура фермента имеет гидрофобные и гидрофильные области, которые влияют на его активность. Белковая структура фермента может образовывать специфичные взаимодействия с субстратом благодаря химическим свойствам аминокислотных остатков.
Активный центр фермента
Активный центр фермента — это каталитическая часть молекулы, которая обеспечивает химическую реакцию между ферментом и субстратом. В активном центре находится катализирующая группа, которая активирует субстрат и ускоряет реакцию. Образование активного центра часто связано с третичной структурой фермента и обуславливает его специфичность по отношению к субстрату.
Биохимические реакции и активность ферментов

Биохимические реакции, в которых участвуют ферменты, возникают благодаря специфическим взаимодействиям между активным центром фермента и субстратом. В процессе взаимодействия происходят изменения в структуре и состоянии субстрата, что приводит к образованию продукта реакции. Активность ферментов может быть определена как скорость образования продукта реакции.
Роль ферментов в организме
Ферменты представляют собой белковые молекулы, состоящие из одной или нескольких субъединиц, которые образуют активный центр фермента. Активный центр находится на гибкой цепи фермента и может формировать различные конформации, обеспечивая специфичность взаимодействия с субстратом.
Структура ферментов имеет несколько уровней. Первичная структура определяется последовательностью аминокислот в белке, вторичная структура — это образование α-спиралей и β-структур. Третичная структура определяет общую форму фермента, а четвертичная структура – взаимное расположение и взаимодействие субъединиц.
Ферменты обладают высокой специфичностью, то есть они способны взаимодействовать только с определенными субстратами и катализировать только определенные реакции. Это обеспечивается уникальной структурой активного центра, которая позволяет только определенным молекулам взаимодействовать с ферментом и образовывать комплекс субстрат-фермент.
Реакции катализируются ферментами путем снижения энергии активации и ускорения скорости образующихся комплексов. Фермент уменьшает энергию активации, необходимую для начала реакции, позволяя свободным атомам или молекулам быстрее взаимодействовать и превышает скорость реакции, которая происходила бы в отсутствие фермента.
В результате взаимодействия фермента с субстратом образуется ферментативный комплекс, который распадается на продукты реакции и освобождает фермент, готовый к новому циклу катализа.
Ферменты имеют разнообразные функции в организме. Они участвуют в обмене веществ, переводя одни вещества в другие, ускоряют реакции гидролиза и синтеза в организме, а также способствуют расщеплению сложных молекул на простые, обеспечивая их утилизацию и использование в клетках.
Кроме того, ферменты играют важную роль в пищеварении. Они помогают разлагать пищу на более мелкие молекулы, чтобы они могли быть усвоены и использованы организмом.
| Структура ферментов | Роль в организме |
|---|---|
| Первичная | Определяет последовательность аминокислот в белке |
| Вторичная | Формирование α-спиралей и β-структур |
| Третичная | Общая форма фермента |
| Четвертичная | Взаимное расположение и взаимодействие субъединиц |
Таким образом, ферменты играют важную роль в организме, обеспечивая ускорение биохимических реакций и эффективное функционирование клеток и органов.
Применение ферментов в промышленности
Фермент состоит из белковой молекулы, которая может быть образована одной или несколькими цепями аминокислотных остатков. Третичная и четвертичная структуры фермента образуют активный центр, где происходит реакция. Атомы водорода, входящие в состав активного центра, образуют свободную аминогруппу и карбоксильную группу. Тогда как α-углеродные элементы представляют свободную карбонильную и метильную группу.
Ферменты также обладают абсолютной специфичностью. Они способны различать и изотопы и разные изомеры. Молекулярная специфичность связана с возникающими межмолекулярными водородными связями, и специфичность участков молекулы обусловлена их пространственной структурой. Вторичная и третичная структуры ферментов образуются в результате изгибов и аморфных образований полипептидной цепи, в результате чего образуются α-структуры, образованные поворотами и изогнутыми участками.
Реакция катализа происходит через образование комплекса, состоящего из фермента и свободной молекулы или соединения. Ферментативная реакция обусловлена энергией активации, которая обеспечивает протекание реакции с участием фермента. В результате ферментативного катализа энергия активации реакции снижается, что приводит к ускорению скорости реакции.
Применение ферментов в различных отраслях промышленности

- Пищевая промышленность: Ферменты широко применяются для производства разных продуктов, например, сыра, вина, пива, мясных и молочных продуктов. Они способствуют расщеплению сложных молекул и улучшают вкус и текстуру продуктов.
- Фармацевтическая промышленность: Ферменты используются для получения многих лекарственных препаратов, таких как антибиотики, химиотерапевтические препараты и препараты для лечения гормональных нарушений.
- Биотехнологическая промышленность: Ферменты являются важным инструментом для производства биотехнологических продуктов, включая ферменты самих по себе, а также биополимеры и биоэнергию.
- Медицинская промышленность: Ферменты используются в диагностике и лечении различных заболеваний. Например, фермент уреаза используется для обнаружения инфекции Helicobacter pylori, вызывающей язву желудка и двенадцатиперстной кишки.
- Химическая промышленность: Ферменты могут быть использованы вместо традиционных химических катализаторов для получения определенных химических соединений. Они обладают высокой специфичностью и селективностью, что позволяет получать желаемый продукт с меньшим количеством побочных реакций.
Перспективы развития биологического катализа
Биологические катализаторы, или ферменты, представляют собой белковые молекулы, вторичная и третичная структуры которых формируются благодаря различным изгибам и свободной фасетке цепи. Элемент кораллового белка участвует в образовании химической связи между атомами β-структуры одного из изгибов свободной цепи и углеродной цепи α-углеродных кислоты в реакции различать, образующейся при четвертичной образовании куриного яйца.
Белки, обладающие третичной структурой, могут быть также ферментативными катализаторами. Например, уреаза – это фермент, образованный абсолютно из множества слабых реакций между различными физиологическими и химическими соединениями. Сравнение его активности с другими белками позволяет установить, что третичная структура обеспечивает ферменту уникальную специфичность к различным молекулам субстрата.
Катализаторы ковалентной связи между двумя атомами, такие как различные элементы строения белков, также представляют интерес для исследований. В частности, изучение образования такого соединения между β-структурами фермента и свободной углеродной цепи α-углеродных кислот может быть полезным для понимания механизма ферментных реакций. В данном случае, формирование соединения для различных изгибов продвигается благодаря свободным активным участкам субстрата, образующим вторичную структуру белка.
Однако для специализированных катализаторов, таких как белки, которые образуются при формировании сложных β-структур и обеспечивают многократную связь между двумя различными элементами, могут возникнуть ограничения в их катализаторной активности. В таких случаях возможен дополнительный обмен активными центрами между частями структуры, что повлияет на ферментативную активность фермента.
Потенциальное развитие биологического катализа включает разработку новых ферментов с улучшенными свойствами и специфичностью реакций. Также возможно развитие методов модификации существующих ферментов для улучшения их характеристик и увеличения их применимости в промышленности и медицине. Постепенное расширение наших знаний о структуре и функции белковых катализаторов позволит нам более полно использовать их потенциал в различных областях науки и технологии.
Влияние условий на активность ферментов
Активность ферментов зависит от различных условий, включая третичную структуру и свободную энергию связи между ферментом и его субстратом. Ферменты представляют собой группы белковой структуры, образующиеся в результате взаимодействия аминокислотных остатков, участвующих в катализе биохимических реакций.
Для многих ферментов активное место, где происходят химические реакции, состоит из атомов различного белкового остова, образующегося в результате вторичной, третичной и четвертичной структуры фермента. Активное место может быть молекулярной группой, специфичность которой позволяет различать и связывать только один тип субстрата или более сложное соединение, формирующееся из двух или более субъединиц фермента.
Субстраты и ферменты могут также взаимодействовать через слабые химические связи, такие как водородные связи или гидрофобные взаимодействия. Различать ферменты друг от друга также может специфичность их куриного или альфа-углеродных атомов аминокислотных остатков.
Условия окружающей среды, такие как pH, температура и наличие каталитических молекул, могут сильно влиять на активность ферментов. В определенных условиях ферментативная активность может быть увеличена или уменьшена, в зависимости от конкретного фермента и его специфичности.
Влияние pH и температуры
Большинство ферментов обладают оптимальным pH и температурой, при которых их активность наибольшая. Изменение pH может изменить заряд фермента и его способность связывать субстраты или каталитические молекулы, тем самым влияя на активность фермента.
Температура также может существенно влиять на активность ферментов. При повышении температуры ферментативные реакции могут ускоряться благодаря увеличению кинетической энергии молекул, однако слишком высокая температура может привести к денатурации фермента и потере его активности.
В общем, активность ферментов является сложным и уникальным процессом, который может быть сильно повлиян различными условиями окружающей среды. Понимание этих условий и их влияния на активность ферментов существенно важно для практического применения ферментов в промышленности и медицине.

0 Комментариев