
Биохимическая термодинамика изучает энергетические изменения, происходящие в клетках организма. Важным понятием в этом контексте является экзергоничность реакций – процессов, при которых высвобождается энергия, и эндергоничность – процессов, требующих энергии для протекания.
Примером экзергонической реакции является дыхательная цепь. В этом процессе молекула глюкозы окисляется до диоксида углерода и воды в присутствии кислорода. В результате осуществляется перенос электронов с энергетически богатых молекул на молекулы более низкоэнергетичные. Константа Гиббса, которая описывает термодинамическое равновесие между реагентами и продуктами, для дыхательной цепи равна -2882 кДж/моль, что говорит о высокой степени экзергоничности этой реакции.
Другим примером экзергонической реакции является декарбоксилирование пируватдегидрогеназного комплекса. Вещество пируват, получаемое в результате гликолиза, претерпевает реакцию, в результате которой происходит окисление пирувата с помощью NAD+ и образуется ацетил-КоА и СО2. Эта реакция также сопровождается выделением большого количества энергии. Процесс декарбоксилирования пируватдегидрогеназного комплекса является ключевым шагом в цикле Кребса, где осуществляется окисление ацетил-КоА при участии ферментов и цитохромоксидазы.
С другой стороны, эндергоническая реакция связана с активацией молекул и потребностью в энергии для протекания процесса. Например, фосфорная киназа – фермент, катализирующий превращение АДФ в АТФ – проводит эндергоническую реакцию. Для синтеза АТФ в процессе гликолиза требуется активная форма киназы, которая фосфорилируется в результате реакции. Энергия, накопленная в активированной форме фосфорной киназы, затем переносится на АДФ, чтобы образовать АТФ.
Таким образом, в биохимических процессах происходят как экзергонические, так и эндергонические реакции. Экзергонические реакции также называются энергетически выгодными, так как они освобождают энергию, которая может быть использована клеткой для различных биологических функций. Эндергонические реакции требуют затрат энергии, но также имеют важное значение для жизнедеятельности организма, так как обеспечивают синтез и обновление молекул, необходимых для клеточных процессов.
Определение биохимической термодинамики
Экзергонические реакции характеризуются образованием свободной энергии, то есть энергией, которая может быть использована для выполнения работы. В таких реакциях энергетическая стоимость веществ, образующихся в результате реакции, ниже энергетической стоимости прекурсоров. Энергия, выделяемая в результате экзергонической реакции, может быть использована клеткой для поддержания метаболических процессов или синтеза необходимых веществ.
Эндергонические реакции, наоборот, требуют затрат энергии для протекания. Такие реакции обычно связаны с синтезом биологически важных веществ, таких как аминокислоты и нуклеотиды. В эндергонических реакциях энергетическая стоимость продуктов выше энергетической стоимости исходных веществ. Энергия, необходимая для эндергонической реакции, поступает из экзергонических реакций, протекающих параллельно в клетке или организме.
Термодинамическое равновесие, достигаемое в биохимических реакциях, определяется свободной энергией Гиббса (G). Если G < 0, то реакция свободно протекает вперед и является экзергонической. Если G > 0, то реакция происходит в обратном направлении, то есть требуется энергетический вклад, и такая реакция является эндергонической.
Примерами экзергонических реакций могут служить процессы дыхания или строения молекул АТФ (аденозинтрифосфат). В этих реакциях большое количество энергии содержится в макроэргической связи фосфатов. Разрыв этих связей сопровождается выделением энергии, которая используется для выполнения клеточной работы.
Термодинамический анализ реакций
Для определения экзергетической эффективности реакций используют молярные количества веществ и их свободную энергию Гиббса. В термодинамическом анализе реакций обычно учитывается температура и концентрация реагентов.
Ряд ферментативных реакций, сопровождающих жизнедеятельность клеток, соединяются межмембранным сопровождением электронов. Например, реакции окислительного фосфорилирования в дыхательной цепи. Эти реакции являются экзергоническими и связаны с образованием крупных количеств энергии.
Существуют также реакции, в которых одно вещество взаимодействует с другим в присутствии катализирующего фермента. Примерами таких реакций могут служить реакции ацетиленового цикла в синтезе сукцината, где тоже образовывается большое количество энергии.
Применение в биохимических процессах
В организмах биохимическая термодинамика применяется для оценки эффективности энергетических процессов. Например, в гемоглобине содержится большое количество энергии, которая освобождается при окислении разделенного сукцинат-электронного транспорта. Также тепловая энергия, используемая организмами, обычно получается из экзергонических реакций, связанных с распадом АТФ или других энергоносителей.
Биохимическая термодинамика помогает понять принципы протекания реакций в живых системах и эффективность превращения энергии. Используя эти знания, можно разрабатывать новые методы лечения и оценивать эффективность биологических процессов в организмах.
| Термин | Определение |
|---|---|
| Экзергонические реакции | Реакции, при которых образуется свободная энергия, которая может быть использована для выполнения работы. |
| Эндергонические реакции | Реакции, требующие затрат энергии для протекания. |
| Свободная энергия Гиббса | Показатель термодинамического равновесия реакции. Если G < 0, то реакция экзергоническая. Если G > 0, то реакция эндергоническая. |
| Макроэргическая связь фосфатов | Связи, содержащиеся в АТФ, содержащие большое количество энергии. |
Функция Гиббса и экзергия в биохимических системах
Функция Гиббса (G) может быть определена с использованием следующей формулы:
G = H — TS
где H — энтальпия системы, T — температура в кельвинах, S — энтропия системы. Эта формула позволяет нам увидеть, как изменится свободная энергия системы при изменении температуры и энтропии.
В биохимических системах функция Гиббса играет ключевую роль в определении того, будет ли реакция самопроизвольной или требуется затратить энергию для ее осуществления. Если изменение свободной энергии (ΔG) меньше нуля, это означает, что реакция экзергоническая и может происходить без внешнего энергетического вклада. Если ΔG больше нуля, реакция эндергоническая и требует затрат энергии.
Примером эндергонической реакции является синтез АТФ в дыхательной цепи. В этом процессе энергия, освобождаемая при окислении пищевых молекул, используется для синтеза АТФ. Это эндергонический процесс, так как требуется внешняя энергия для преобразования ADP и фосфата в АТФ..
Примером экзергонической реакции является молекулярный перенос электрона, который происходит в митохондриях при окислении НАДН-дегидрогеназы. В этом процессе связывание двух электронов на молекуле меди приводит к освобождению энергии. Эта энергия используется для приведения протона через цепь белковых комплексов, что приводит к созданию разности концентрации протонов наружной и внутренней сторонах митохондриальной мембраны. Эта разность концентраций протонов затем используется для синтеза АТФ.
Таким образом, функция Гиббса и экзергия играют важную роль в биохимических системах, определяя направление и энергетическую эффективность различных процессов, таких как синтез АТФ и молекулярный перенос электрона. Понимание этих концепций позволяет нам лучше понять биологическое и химическое взаимодействие, которое происходит в клетке.
Некоторые практические примеры таких процессов включают в себя окислительное фосфорилирование в митохондриях и окисление гемоглобина в крови. В этих процессах свободная энергия от оксигеназы бурого окисления переносится на АТФ и гемоглобин соответственно. Использование функции Гиббса и экзергии позволяет нам формально измерить количество энергии, доступной для использования в этих реакциях, помогая нам лучше понять и оценить эффективность энергетического обмена в живых системах.
Экзергонические реакции в биохимии
Одним из известных примеров экзергонической реакции является окисление глюкозы в митохондриях. В процессе гликолиза глюкоза разлагается на пироуксусную кислоту, при этом выделяется энергия, которая используется для синтеза АТФ. Энергия, содержавшаяся в глюкозе, освобождается с помощью ферментов, таких как дегидрогеназа и цитохромоксидаза, и переходит через ряд экзергонических реакций, образуя много молекул АТФ.
Экзергонические реакции в биохимии также связаны с многими другими биохимическими процессами, такими как фосфорилирование, окисление аминокислот и жирных кислот. Все эти процессы связаны с превращением энергии из одной формы в другую.
Важным аспектом экзергонических реакций является наличие коэнзимов, которые играют роль переносчиков энергии. Один из таких коэнзимов — АТФ, которое используется для накопления и передачи энергии. Также важным является нахождение соединения с высоким потенциалом окисления, такого как НАДН или ФАДН, которое может служить энергетическим субстратом для других реакций.
В митохондриях существуют цепь окисления и фосфорилирования, которые являются основными источниками экзергонической энергии. Процесс окисления глюкозы через гликолиз и кардионетаболическое окисление глюкозы в митохондриях является одной из стадий образования АТФ. В величину экзергонического потенциала входит как химотермическая энергия реагирующих молекул глюкозы и кислорода, так и электрохимическая энергия в форме разности электрохимических потенциалов, которые участвуют в формировании протонного градиента через митохондриальную мембрану.
Экзергонические реакции в биохимии имеют большое значение для жизнедеятельности организмов, так как они обеспечивают постоянное высвобождение энергии, необходимое для поддержания множества жизненно важных процессов.
Эндергонические реакции и их роль в метаболизме

В биохимической термодинамике существуют два типа реакций: экзергонические, при которых выделяется энергия, и эндергонические, требующие энергии для совершения. В данной статье мы рассмотрим эндергонические реакции и их значимость для клеточного метаболизма.
Эндергонические реакции осуществляются при низкой концентрации продуктов и реагентов в клетке. Они позволяют сохранять энергию, которая затем может быть использована в других процессах. Один из примеров эндергонической реакции в клетке — синтез АТФ при фотосинтезе.
Решение
В процессе фотосинтеза растительные клетки преобразуют энергию света в химическую, использовуя фотосинтетический пигмент — хлорофилл. При этом солнечная энергия поглощается хлорофиллом и используется для преобразования углекислого газа и воды в глюкозу и кислород.
Данный процесс состоит из двух фаз: световой и темновой. В световой фазе солнечная энергия используется для создания энергетического связи — АТФ. АТФ, в свою очередь, является источником энергии для выполнения клеточных функций. Темновая фаза фотосинтеза — это процесс, в ходе которого глюкоза синтезируется из АТФ.
Таким образом, фотосинтез является эндергонической реакцией, которая позволяет растительным клеткам запасать энергию в виде АТФ для использования в дальнейшем метаболизме и других важных клеточных процессах.
Роль эндергонических реакций в метаболизме
Важной функцией эндергонических реакций является снабжение клетки необходимой энергией для проведения различных физиологических процессов. В таких процессах, как синтез белков, ДНК, РНК или клеточное деление, требуется большое количество энергии, которая обеспечивается эндергоническими реакциями.
Один из важных молекул, обеспечивающих энергию в клетке, — АТФ (аденозинтрифосфат). АТФ служит переносчиком энергии и участвует во многих клеточных процессах, таких как активный транспорт, сокращение мышц, синтез биомолекул и другие.
Также эндергетические связи АТФ могут быть разрушены, и энергия освобождается для использования в клетке. Разделение АТФ на АДФ (аденозиндифосфат) и независимый фосфат сопровождается выделением энергии, которая может быть использована для осуществления эндергонических реакций в клетке.
Таким образом, эндергонические реакции имеют важное значение для поддержания энергетического баланса в клетке и обеспечивают необходимую энергию для выполнения различных физиологических процессов.
Примеры экзергонических и эндергонических реакций в биохимии
В биохимических системах существует много реакций, которые можно классифицировать как экзергонические и эндергонические. Экзергонические реакции освобождают свободную энергию, тогда как эндергонические реакции требуют энергии для их осуществления.
Экзергонические реакции
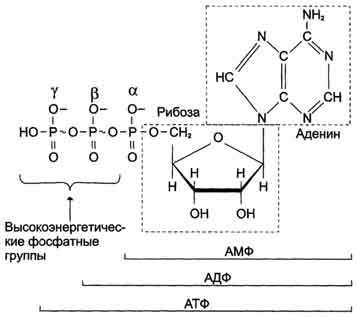
Одним из примеров экзергонических реакций является реакция гидролиза АТФ (аденозинтрифосфата) до АДФ (аденозиндифосфата) и ортофосфата. В этом процессе осуществляется передача энергии от АТФ к другим молекулам или биохимическим реакциям. Данный процесс связан с формированием энергетических связей, и в результате его осуществления свободная энергия, связанная с этими связями, освобождается и может быть использована в различных реакциях в организме.
Еще одним примером экзергонической реакции является цикл Кребса, также известный как цикл цитратного синтеза. В ходе этого процесса молекула ацетил-КоА окисляется до диоксида углерода, сбраживая энергию, которая затем используется для образования НАДН и ГТФ (гуанил-трифосфата). Эта реакция осуществляется в митохондриях и представляет собой основной путь для образования энергии в клетке.
Эндергонические реакции
Примером эндергонической реакции является синтез глюкозы из молекул диоксида углерода и воды в процессе фотосинтеза. В данной реакции требуется энергия солнечного излучения для преобразования света в химическую энергию, которая заключена в связях глюкозы. Это основной способ получения организмами растений энергии из света.
Другим примером эндергонической реакции является реакция фосфорилирования АДФ до АТФ в процессе окислительного фосфорилирования в дыхательной цепи. В ходе этой реакции осуществляется передача электронов через серию ферментов и транспортных систем в митохондриальной мембране. Энергия, поглощаемая в результате окислительной реакции, используется для превращения АДФ в АТФ через связывание водорода с молекулами кислорода в цитохромоксидазе.
Термодинамическое равновесие в биохимических системах важно для поддержания обмена энергии и реализации необходимых биохимических процессов. Оно может быть достигнуто за счет балансирования концентрации реагентов и энергетических потенциалов. При этом важно учесть, что большинство биохимических реакций являются необратимыми при физиологических условиях и могут быть осуществлены только при определенной температуре.
Итак, экзергонические и эндергонические реакции в биохимии являются фундаментальными процессами, которые входят в множество циклов и систем в организме. Эти реакции используются для синтеза новых молекул, передачи энергии и поддержания жизненных процессов.
Использованная литература
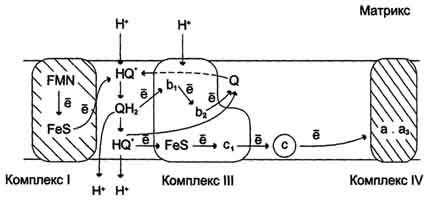
При этом эндеергонические реакции, такие как синтез АТФ, происходят с использованием энергии, образующейся в результате окисления экзотермических реакций в биохимических системах. Однако изменение свободной энергии эндергонических реакций, используемых в биохимическом синтезе, контролируется не только изменением концентрации реагентов, но и относительной концентрацией катализаторов и ферментов в системе.
В химической термодинамике установлено, что водородный потенциал мембраны является основным участником в энергетическом обмене, а изменение потенциалов кислородно-водородной трансферазы, а также контроль над потенциалом мембраны, ставят в центр внимания биологическую термодинамику.
В работе использованы источники издательства «Биологическое издательство».

0 Комментариев